Unidad 1
La Química es parte de la Ciencia que estudia la obtención, las propiedades y la transformación de las Sustancias Puras y los sistemas que ellas forman.
La Química es parte de la Ciencia que estudia la obtención, las propiedades y la transformación de las Sustancias Puras y los sistemas que ellas forman.
La Ciencia es el conocimiento obtenido a través del llamado método científico.
El método científico es un modo natural, ordenado, racional y sistemático de obtener el conocimiento. Este modo comienza con la observación de un fenómeno, continúa con la formulación de hipótesis que intentan explicar lo observado, prosigue con losexperimentos que permiten confirmar y descartar las hipótesis. Como resultado de las actividades descritas se obtienen conocimientos particulares que se expresan mediante las leyes científicas . Una visión más general de un tema sostenida por varias leyes se denominateoría.
Las Sustancias Puras son una manifestación más o menos sofisticada de la materia y la comprensión del concepto se alcanza luego de un estudio breve de los diferentes sistemas materiales. La materia es todo lo que tiene masa o pesa y puede ser perceptible o imperceptible por nuestros sentidos.
Los Sistemas Materiales
El Estudio de los Sistemas materiales debe relacionarse fundamentalmente con aspectos estructurales y propiedades de la materia.
El aspecto estructural fundamental es el carácter discontinuo, corpuscular o particulado de la materia que se manifiesta en fenómenos de difusión y cambios de estado físico.
Modelo Estructural Molecular de las Sustancias Puras
1 .- Un cierto tipo de partículas, llamadas moléculas, invisibles y que poseen cualidades que veremos a continuación, nos permiten comprender el concepto de Sustancia Pura.
2.- Una Sustancia Pura es un conjunto de moléculas idénticas, de igual tamaño, masa, y forma.
Ejemplos:
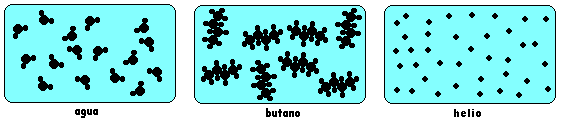
Podemos así también inferir una definición de molécula: La menor porción material en que se puede presentar una Sustancia Pura.
3.- Las moléculas tienen la cualidad del movimiento, poseen Energía Cinética que es proporcional a la temperatura y además se atraen entre sí mediante fuerzas de atracción intermoleculares que son de naturaleza eléctrica..
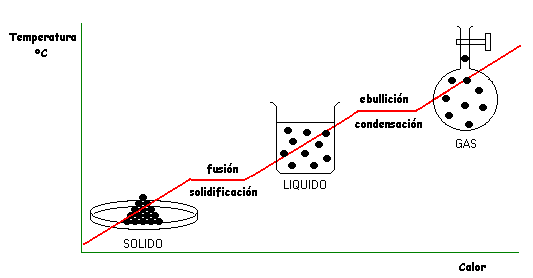
4.- En los cambios de tipo físico, que para las sustancias puras ocurren a temperaturas bien definidas, las moléculas permaneceninalteradas y por ello a este tipo de cambios se les denomina comunmente reversibles.
Más información
A los estados fisicos de la materia ya mencionados podemos agregar los estados de cristal líquido y el estado de plasma
Los cristales liquidos pueden presentar varios ordenamientos moleculares de tipo esméctico, estado nemático y colestérico
Las Sustancias Puras y las propiedades
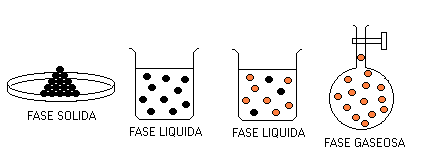
Los cambios de tipo físico de una sustancia pura nos muestran la necesidad de considerar el aspecto propiedades de los sistemas materiales. Esto es, si bién se trata del mismo tipo de moléculas , las propiedades (color, densidad, viscosidad, temperatura, etc. ) del sólido difieren de las del líquido y éste de las del gas.
El aspecto propiedades de los sistemas materiales se enfrenta con el concepto de Fase.
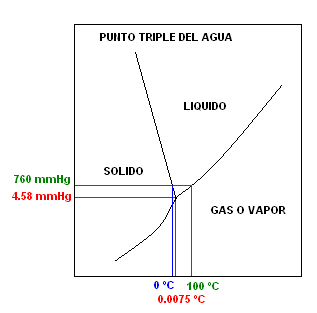
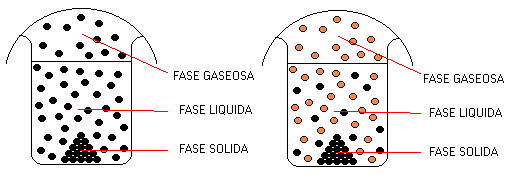
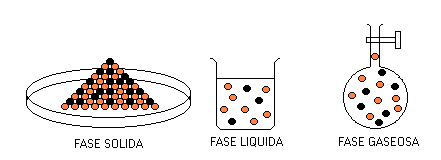
Una Fase es una porción de materia que posee idénticas propiedades, tanto físicas como químicas, en toda su extensión. En consecuencia los cambios de estado físico son cambios de Fase. Entonces una Sustancia Pura puede ser una fase sólida o una fase líquida o una fase gaseosa dependiendo de la temperatura a la que se encuentre. Durante el cambio de estado coexisten dos fases a la temperatura de la transición correspondiente.
A una determinada presión y a una determinada temperatura, una Sustancia Pura puede presentar coexistencia (existencia simultánea) de tres fases como representa el gráfico a continuación.
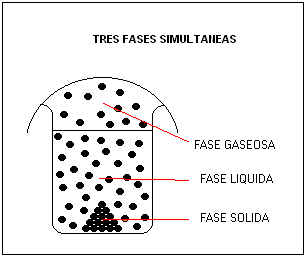
La primera categorización de los Sistemas Materiales está basada exclusivamente en el concepto de Fase.
EJEMPLOS DE SISTEMAS HETEROGENEOS
3 Fases
1 Sustancia Pura 2 Sustancias Puras
2 Fases
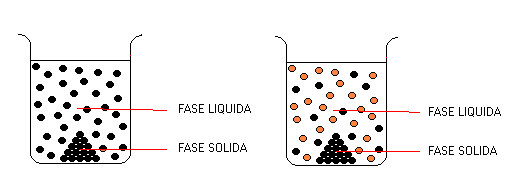
1 Sustancia Pura 2 Sustancias Puras
2 Sustancias Puras
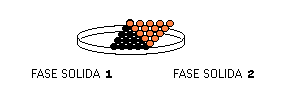
Muchos sistemas heterogéneos, a simple vista aparentan ser homogéneos y su categoría se decide luego de un examen al microscópio. La leche constituye un buen ejemplo, a simple vista parece homogénea pero al microscópio se observa claramente como heterogénea. Los aceros constituyen otros ejemplos, son sistemas heterogéneos del tipo Fase Sólida 1-Fase Sólida 2 o más complejos.

Estos sistemas que aparentan ser homogéneos pero al microscopio se observan heterogéneos reciben el nombre de coloides y la siguiente tabla muestra algunos tipos de ellos.
| Fase Dispersa | ||||
|---|---|---|---|---|
| Fase Continua | Gas | No es posible porque todos los gases son solubles entre sí | Aerosol líquido,Ejemplos: niebla, bruma | Aerosol sólido,Ejemplos: Humo, polvo en suspensión |
| Líquido | Espuma,Ejemplos: Espuma de afeitado | Emulsión, (Líquidos insolubles)Ejemplos: Salsa mayonesa, crema de manos, | Dispersión coloidalSuspensión o Sol,Ejemplos: Leche, Sangre, Pinturas, tinta china | |
| Sólido | Espuma Sólida,Ejemplos: piedra Pómez | Gel,Ejemplos: Gelatina, gominola, queso | Emulsión sólida,Ejemplos: Cristal de rubí | |
ANALISIS DE SISTEMAS HETEROGENEOS
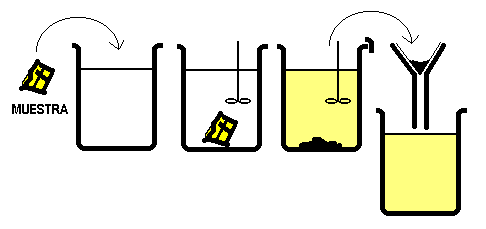
Analizar un sistema heterogéneo significa separar las diferentes fases que lo conforman.
TECNICAS DE SEPARACIÓN DE FASES DE SISTEMAS HETEROGENEOS
FILTRACIÓN
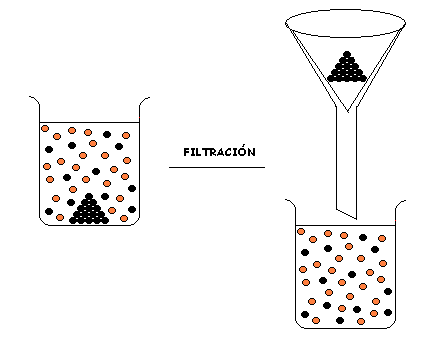
FILTRACIÓN SIMPLE
FILTRACION CON SUCCIÓN O DE VACÍO

DECANTACION


CENTRIFUGACIÓN

SUBLIMACIÓN

DISOLUCIÓN
TAMIZACIÓN


No es una técnica de carácter sistemático, y tendría utilidad cuando el tamaño de grano del material particulado fuese significativamente diferente para cada una de las fases ( separación de arena de rio y harina ).
EJEMPLOS DE SISTEMAS HOMOGENEOS
1 Fase
Si observamos las fases líquidas del anterior ejemplo de sistemas homogéneos observamos una diferencia en cuanto al tipo de partículas que forman tales sistemas. De aquí aparece la necesidad de establecer otras categorías de sistemas materiales, esta vez respecto al número de tipos de partículas que forman el sistema.
EJEMPLOS DE SOLUCIONES
Las soluciones sólidas las encontramos en sistemas más conocidos como aleaciones ( bronce, aleación de cobre y estaño). La salmuera ( agua con sal común) es líquida y el aire (Oxígeno, Nitrógeno etc..) es gaseosa.
Los cambios de Estado Físico de las Soluciones también ocurren por variación de la temperatura. Los valores de las temperaturas de transición no son fijos como en las Sustancias Puras, sino que dependen de la proporción en que se encuentren los distintos tipos de moléculas.
Se consideran sistemas homogéneos porque los microscopios corrientes no tienen poder de resolución a nivel molecular
Analizar un sistema homogéneo significa separar las diferentes Sustancias Puras o tipo de moléculas que lo conforman.
TECNICAS DE SEPARACIÓN DE SUSTANCIAS PURAS DESDE SISTEMAS HOMOGENEOSDESTILACIÓN
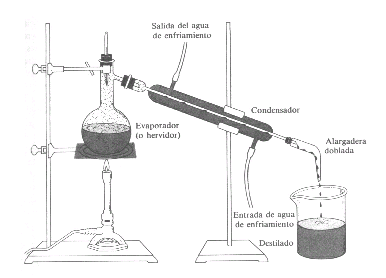

Rotavapor .
El Rotavapor permite la destilación a presión reducida o ligero vacío, de esta forma se logra una disminución de la temperatura de ebullición del solvente. Esta modalidad es conveniente cuando se desea evitar que los solutos de origen biológico se "desnaturalicen " o deterioren por excesivo calentamiento.
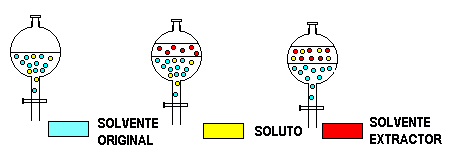
El soluto es extraído del solvente original por un solvente extractor, inmiscuible con el primero, y que disuelve mejor al soluto
CRISTALIZACIÓN
CONCEPTO PREVIO DE SOLUBILIDAD La Solubilidad es la mayor cantidad de soluto, que en forma estable, se puede disolver en una determinada cantidad de solvente a una temperatura y presión dadas. Cuando la solución tiene disuelto la cantidad de soluto que corresponde a la solubilidad se dice que la solución está saturada
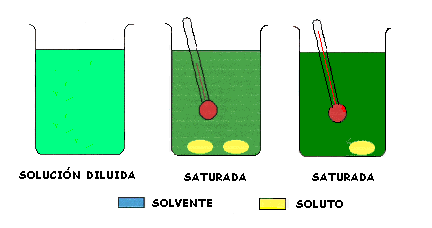
La Solubilidad de los sólidos en líquidos por lo general aumenta cuando aumenta la Temperatura.
En la cristalización se lleva a la solución a la condición de saturación a una temperatura alta, luego se deja enfriar lentamente y como la solubilidad es menor a menores temperaturas se forman cristales.
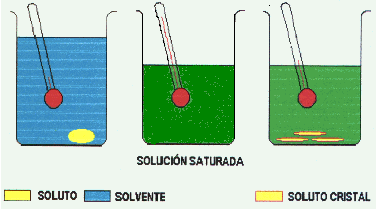
Los cristales se forman a partir de pequeños "nucleos de cristalización" ( formados por siembra de pequeños cristales, aristas de vidrio de los vasos o bien espontáneamente). Mientras menor cantidad de nucleos de cristalización se formen, mejores y mayores cristales se obtienen. Mientras más grande sea el cristal formado , la sustancia es más pura o menos contaminada con impurezas.

Las diferentes Sustancias Puras de una mezcla se pueden separar por Cromatografía. Una muestra ( mezcla de moléculas coloreadas azul y rojo en el siguiente gráfico) se siembra en un soporte fijo o estacionario. El flujo de una fase movil arrastra de diferente manera ( separa ) los distintos tipos de moléculas.
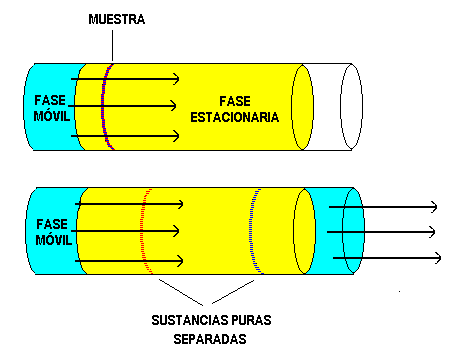
Las moléculas son retenidas por la fase estacionaria mediante fuerzas de retención y al mismo tiempo son arrastradas por la fase movil mediante fuerzas de arrastre. La intensidad de estas fuerzas ( de naturaleza eléctrica ) son propias de cada sustancia. Si una sustancia es pobremente retenida pero fuertemente arrastrada tendrá un bajo tiempo de elución en cambio otra que es fuertemente retenida y pobremente arrastrada demorará mucho en cruzar la fase estacionaria y tendrá un tiempo de elución elevado.
El tiempo de elución para una determinada sustancia es constante para una fase estacionaria, fase movil, flujo y largo de columna determinados y es por lo tanto un factor de identificación de las sustancias.

Cromatografía líquida de capa fina.
Fué la primera en desarrollarse, las diferentes sustancias separadas eran reconocidas mediante reactivos que daban coloraciones particulares. De allí el nombre del método ( Chromos = Color ). Tiene utilidad de reconocimiento de diferentes Sustancias

Cromatografía líquida en columna
Usada con fines preparativos ( separar cantidades significativas de diferentes sustancias). La fase movil (líquido) desciende por gravedad. Es común detectar el descenso de las sustancias alumbrando el sistema con luz UV (ultravioleta)
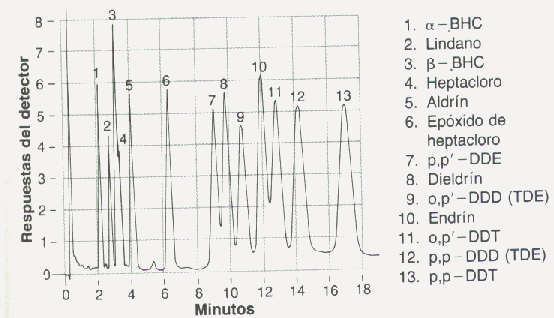
Registro de Cromatografía de Gases
La fase estacionaria rellena un serpentín. Se hace fluir un gas como fase móvil en forma constante a presión constante. Se mide el tiempo de elución de la fase móvil y con el se comparan los tiempos de elución de las diferentes sustancias. Las sustancias son detectadas por métodos acoplados a sistemas electrónicos. Estos identifican y cuantifican los componentes del sistema mediante los correspondientes registros.
La cromatografía HPLC (High Performance Liquid Chromatography) además de identificar y cuantificar sirve a propósitos preparativos. En estos es sistemas es posible trabajar con fases moviles, mezclas de solventes, con gradientes programados de composición..
LAS SUSTANCIAS PURAS
EL CAMBIO QUÍMICO Y LAS LEYES FUNDAMENTALES
Sabemos que una Sustancia Pura es un sistema formado por un tipo de moléculas características para esa Sustancia, es decir de tamaño, masa y forma bien definidas. Cuándo las Sustancias Puras reciben energía mayor que la necesaria para que acontezcan los cambios físicos sus moléculas se modifican, variando el tamaño, la masa y la forma, es decir se transforman en moléculas o Sustancia Puras distintas de las iniciales. En estos casos ha ocurrido un Cambio Químico o Reacción Química.
Cambio Químico
Sustancia (s) Pura (s) Inicial (es) ------> Sustancia (s) Pura (s) Final (es) Molécula (s) Inicial (es) ------> Molécula (s) Final (es)
Reaccionante (s) ------> Producto (s)
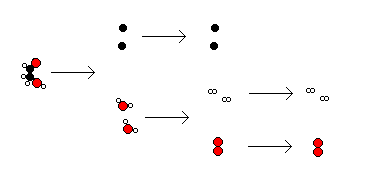
Se observa que algunas moléculas se rompen en fragmentos o degradan con relativa facilidad, finalmente se llega a fragmentos o moléculas muy resistentes a la ruptura o degradación. Estas últimas sustancias de difícil ruptura o degradación se consideran fundamentales y se les denomina Elementos y con ellas se formarían aquellas más complejas y que se les denomina Compuestos. Una definición precisa de estos conceptos surge cuando se aclaran aspectos estructurales de las moléculas.
Ley de la Conservación de la Materia (Lavoisier)
En un cambio químico la masa de los reaccionantes es igual a la masa de los productos.
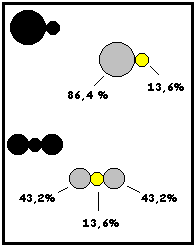
Ley de las Proporciones Definidas ( Proust)
La proporción en que los elementos se combinan para formar compuestos es definida o constante no importando laprocedencia del compuesto.
Ejemplo El sulfuro de plomo es un compuesto (negro) formado por los elementos plomo ( plomo) en 86,4% y azufre ( amarillo) en 13,6 %. Esto significa que por cada 100 g. de sulfuro de plomo 86,4 g. corresponden a plomo y 13,6 g. a azufre.
Así, si colocamos en un crisol para hacer reaccionar y calentamos:
0,864 g de plomo y 0,136 g de azufre se formará 1 g. de sulfuro de plomo.
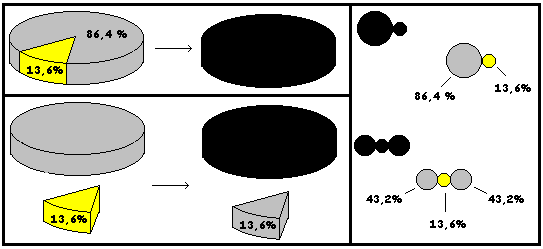
Y, si colocamos en un crisol para hacer reaccionar y calentamos:
1,0 g de plomo y 0,136 g de azufre se formará 1 g. de sulfuro de plomo y sobrarán 0,136 g de Plomo
que no logran combinarse.
Puesto que el sulfuro de plomo es una Sustancia Pura, debe estar formado por moléculas iguales. Además en todas ellas deben estar los elementos plomo y azufre en la misma proporción que se observa en las muestras macroscópicas. Aquí aparece la noción "porción definida de un elemento"
Ley de las proporciones Múltiples (Dalton)
Los pesos de un elemento que se combinan con una cantidad fija de un segundo elemento cuando se forman dos o más compuestos están en relación de números enteros.
Ejemplo: Peso de hidrógeno combinado con 1 g de nitrógeno en amoníaco 3
________________________________________________ = _______
Peso de hidrógeno combinado con 1 g de nitrógeno en hidrazina 2
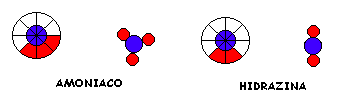
La ley y su implicancia a nivel molecular
Esta vez el concepto " porción definida de un elemento" se refuerza fuertemente y conduce al concepto definido de atomo
MODELO ATÓMICOLas leyes fundamentales recién estudiadas demuestran que las moléculas a su vez están formadas por otras partículas aún más pequeñas. Estas nuevas partículas se denominan átomos y deben poseer las siguientes cualidades:
1.- Los átomos son partículas, que mediante fuerzas denominadas enlace químico, se unen para formar las moléculas.
2.- Cada elemento tiene un átomo característico, es decir , de tamaño y masa determinados. Existen tantos tipos de átomos como de elementos. ( Los Elementos son aquellas Sustancias que mediante Símbolos se presentan en el Sistema Periódico)
3.- Si los átomos se presentan solitarios, o bien unidos del mismo tipo, se trata de moléculas de un Elemento.
Si los átomos se presentan unidos, de distinto tipo, se trata de molécula de un Compuesto.
4.- Un Cambio Químico es un reordenamiento de átomos
LOS ELEMENTOS Y LOS COMPUESTOS
Con esta visión más profunda de los aspectos estructurales de la materia (modelo atómico) se comprenden categorias aún mas finas de los sistemas materiales, esta vez en relación a las SustanciasPuras.
Análisis de Sustancias Puras
El análisis de Sustancias Puras corresponde al denominado Análisis Químico.
Análisis Químico Cualitativo Este comprende la separación e identificación de los elementos que forman un compuesto.
Análisis Químico Cuantitativo Este comprende la medición de la cantidad de cada uno de los elementos que forman el compuesto.
SUSTANCIA PURA
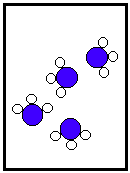
ELEMENTOS COMPUESTO
Inevitablemente para separar elementos desde los compuestos hay que recurrir a reacciones. El método más importante para separar elementos de su compuesto es la electrólisis.
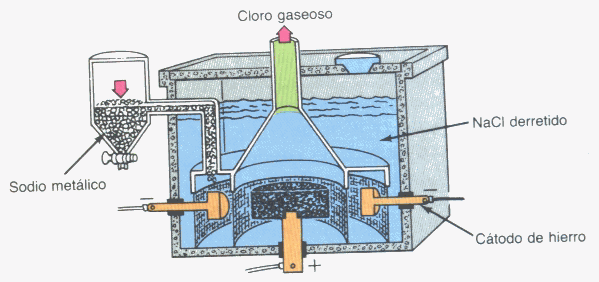
Obtención de Cloro y Sodio a partir de Cloruro de Sodio por electrólisis.
También son utiles la formación de sales insolubles o precipitados y la formación de complejos.
Una molécula de una Sustancia Pura se representa por su Fórmula
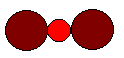 Una molécula de Oxido de Cobre (I) se representa por Cu2O
Una molécula de Oxido de Cobre (I) se representa por Cu2O El número de átomos del elemento se indica con un subíndice después del Símbolo y se llama Atomicidad.
Un reordenamiento de atomos de un cambio Químico se representa por su Ecuación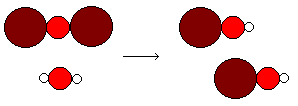
Un reordenamiento de atomos de la formación del hidróxido de cobre (I) se representa por
Cu2O + H2O = 2 Cu OH
El número de partículas idénticas se indica delante de la fórmula con el Coeficiente Estequiométrico
Algunas características de agrupación de los átomos al formar moléculas se indican usando paréntesis.
CuO2H2 Cu(OH)2
EL PROBLEMA DE LA DETERMINACIÓN DE LAS FORMULAS
¿Cuántos átomos de plomo hay en la molécula ¿Cuántas naranjas hay en la bolsa?
de súlfuro de plomo?
1?, 2?, .... 3?, ........... 4?........y de azufre? ¿Cuánto pesa cada naranja?
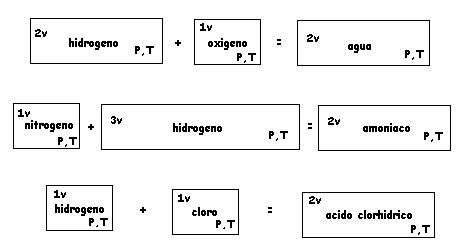
LEY DE VOLUMENES DE COMBINACIÓN DE GASES ( Gay Lussac)
Los volumenes de gases de Reaccionantes y Productos, medidos en iguales condiciones de Presión y Temperatura, están en relación de números enteros.
¿Porqué esa relación de volumenes? ¿Cuál es la fórmula de las moléculas de esas sustancias?
HIPOTESIS O PRINCIPIO DE AVOGADRO

Amadeus Avogadro En volumenes iguales, de cualquier gas, medidos en iguales
condiciones de P y T existe igual número de moléculas.
La Presión que ejercen las moléculas al chocar con las paredes del recipiente depende:
1) de la magnitud de los Impactos = masa x velocidad
(relacionable con la Energía Cinética = 1/2 masa x velocidad 2 y proporcional a la temperatura)
2) del número de Impactos ( proporcional al número de moléculas)
Avogadro razona:
Si las temperaturas son iguales, las magnitudes de los impactos son iguales (m v = m’v’, la molécula liviana se mueve rápido y la pesada se mueve lento) y si las presiones son iguales, el número de Impactos ( número de moléculas) son iguales.
Aplicando el Principio de Avogadro recién enunciado a lo observado por Gay Lussac según los ejemplos ya entregados se concluye que los volumenes de reaccionantes y productos observados se explican mediante las siguientes proposiciones de reordenamientos:

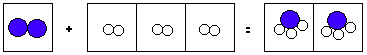
2 H 2 + O 2 = 2 H 2 O
N 2 + 3 H 2 = 2 NH 3
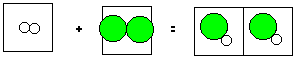
H 2 + Cl 2 = 2 H Cl
La Hipótesis de Avogadro no sólo explica los experimentos de Gay Lussac y permite conocer la fórmula de las moléculas de gases simples, sino que permite, pesando volumenes iguales de diferentes gases medidos en iguales condiciones de P y T donde hay igual número de átomos, establecer la primera relación de masas de los diferentes átomos.
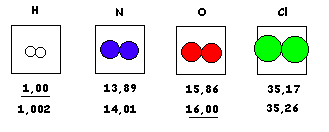
Primeras escalas de Pesos Atómicos o Pesos relativos.
Estos pesos permitieron las relaciones de la Ley de las Proporciones Recíprocas, que junto a otras reglas, permitieron conocer la masa relativa de otros átomos como los de elementos metálicos.
Avogadro, cuando presentó su hipótesis en 1811, era un joven desconocido y su aporte no fue reconocido sino hasta el 1858 cuando la fuerza de lo verdadero se impuso. Medio siglo de masiva dependencia intelectual y carencia de espíritu crítico, situación incomprensible e inaceptable entre quienes se supone hacen la Ciencia.
Unidad 2
Unidad 2
La materia y la Electricidad
Diferentes experimentos demuestran la existencia de dos tipos de electricidad, se les denomina la positivay la negativa. Si dos cuerpos poseen igual tipo de carga se repelen en tanto que si tienen cargas de distinto signo se atraen.En sus experimentos de electrólisis, Faraday determinó la proporcionalidad entre la cantidad de sustancias transformadas y la cantidad de electricidad empleada. Surge la noción que la corriente eléctrica es un flujo de partículas que se les llamó electrones.
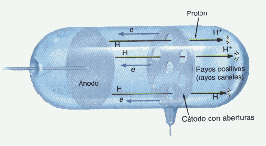
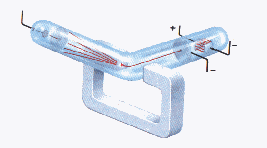
Thompson demuestra experimentalmente, con el tubo de rayos catódicos la existencia de los electrones.

Tubo de rayos catódicos
Los electrones resultan ser partículas de carga eléctrica negativa cuya razón:
Carga
_________________ = 1,76 . 10 8 (Coulomb / gramo)
Masa
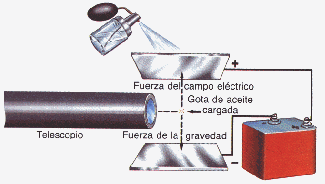
Millikan determina la carga eléctrica del electrón en su clásico experimento de la gota de aceite.

Experimento de la gota de aceite de Millikan
Así la carga del electrón se establece en 1,6 . 10 -19coulomb y su masa en 9,1. 10 –28 gramos.
LAS PARTICULAS INTRATOMICAS FUNDAMENTALES
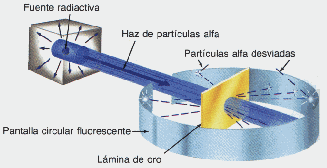
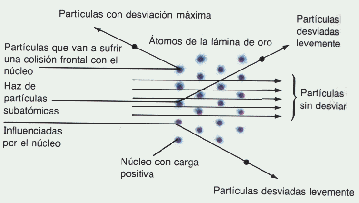
Rutherford, bombardea una lámina de oro, con rayos a ( partículas "pesadas", cargadas positivamente)

Experimento de Rutherford

Dispersión de los rayos a por lámina de oro
Rutherford concluye que la lámina de oro es prácticamente vacía, o mejor, el átomo de oro concentra toda su masa en un núcleo de carga positiva de volumen muy pequeño en relación al volumen atómico total.
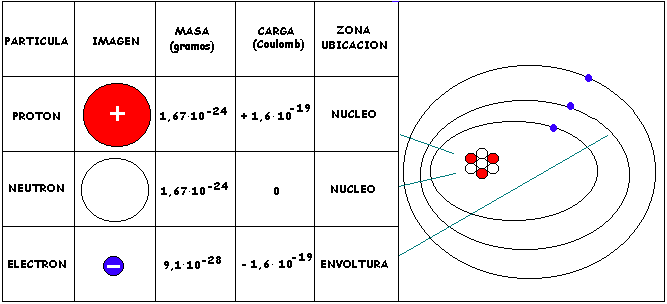
Comprende la presencia en el núcleo del átomo, de los protones, partículas cargadas positivamente y de masa mayor que la del electrón y que ya habían sido detectadas con el tubo de Thompson. También se comprende la presencia en el nucleo de los neutrones, partículas de igual masa que el protón pero sin carga eléctrica.
El nucleo, por la presencia de los protones, tiene carga positiva y por esta razón atrae los electrones (cargas negativas) que giran a su alrededor en órbitas semejantes, en una primera aproximación a las órbitas planetarias del sistema solar.
LA VISION ATOMICA DE RUTHERFORD

NOMENCLATURA PARA SISTEMAS ATOMICOS Y SUS MODIFICACIONES.
NUMERO MÁSICO CARGA ELÉCTRICA O ESTADO DE OXIDACIÓN A CARGA
SÍMBOLO S
NÚMERO ATÓMICO ATOMICIDAD Z X

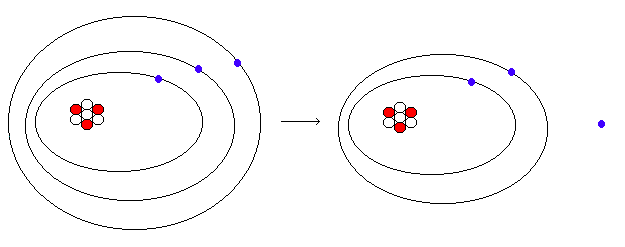
7 0 7 +1
Li = Li + e-
3 3
ión positivo
1 unidad de masa atómica, 1 (u.m.a.), equivale a 1/12 de la masa del átomo de 12C.
1 unidad de masa atómica prácticamente coincide con la masa de un protón o de un neutrón.
1 (u.m.a.) = 1, 67 . 10 - 24 ( g ).
DETERMINACIÓN DE LOS PESOS ATOMICOS O PESOS RELATIVOS
La existencia de isótopos (átomos de distinta masa) en todos los elementos debe ser tomada en cuenta cuando se trata de determinar las relaciones de los pesos de los átomos. En la actualidad es posible conocer los distintos tipos de isótopos que presenta un elemento en su estado natural y además es posible saber en que proporción o cantidad se encuentran gracias a la tecnología del espectrógrafo de masas.

Espectrógrafo de masas
El espectrógrafo de masas es un aparato en que por descargas eléctricas los átomos de un elemento se transforman en iones positivos. Estos iones son conducidos a la forma de un haz lineal hasta una zona en que son desviados mediante dispositivos magnéticos o eléctricos de acuerdo a la masa del ión ( los iones más pesados se desvían menos ). Así los iones en diferentes haces según su masa son detectados y cuantificados.
El Peso Atómico relativo se calcula de la siguiente manera:
A r = A1 * X1 + A2 * X2 + .............
Donde los A i son los Números Másicos o bién la masa en Unidades de Masa Atómica ( u.m.a.) de los distintos Isótopos y los X = % abundancia / 100
Ejemplo de cálculo del Peso Atómico
El Neón tiene dos isótopos.
El 20 Ne que tiene una masa de 19,992 u.m.a. y el22Ne que tiene una masa de 21,991 u.m.a.
Por cada 100 atomos de la muestra natural 90 corresponden al 20Ne y 10 al 22 Ne, es decir, sus abundancias relativas son de 90% y 10% respectivamente.
El cálculo del Peso Atómico será:
PA Ne = 0.90 * ( 19,992 u.m.a.) + 0,10 * ( 21,991 u.m.a.) = 20 , 192 u.m.a.
LA ENVOLTURA DE LOS ATOMOS
La determinación de la disposición de los electrones alrededor del nucleo atómico ha sido un inmenso logro de científicos de las Matemáticas, la Física y la Química. Los resultados de las investigaciones muestran aspectos sorprendentes de la naturaleza de la materia y la energía. Estos aspectos, en relación al atomo, permiten fundamentalmente la comprensión del comportamiento químico de las sustancias.
Unidad 3
LAS ONDAS ELECTROMAGNETICAS Y LA ENERGÍA
Las ondas electromagnéticas son campos eléctricos (E) y magnéticos (H) variables, oscilantes y mutuamente perpendiculares que se desplazan por el espacio y se relacionan íntimamente con el concepto de energía
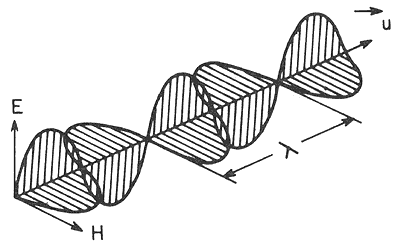
Onda electromagnética
MAGNITUDES Y CUALIDADES DE LAS ONDAS 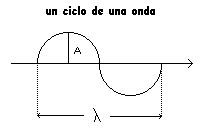

A = Amplitud de la onda (La mayor oscilación respecto de la posición de equilibrio)
c = velocidad de propagación de la onda ( cm/ seg)
l = longitud de onda ( lambda) desplazamiento del frente de onda en un ciclo (cm)
T = Período ( tiempo de un ciclo ) (seg)
n = frecuencia ( nu ) = 1/T seg –1 = ciclos/seg = Hertz
Ecuación fundamental l = c T
_
:. l = c / n :. n = c / l :. n = 1 / l (N° de ondas ) cm -1
Un fenómeno inherente a la naturaleza de las ondas es la interferencia. Es decir, si las ondas se encuentran en fase se suman sus amplitudes, en cambio si las ondas están desfasadas se anulan mutuamente y la amplitud de la onda resultante puede ser nula.
El fenómeno de la difracción de las ondas es una clara manifestación de la propiedad de interferencia de las ondas. Los ribetes de claridad y oscuridad que acompañan la sombra de los bordes de la hoja de afeitar son consecuencia del fenómeno de la difracción y prueban la naturaleza ondulatoria de la luz.

Difracción de la luz
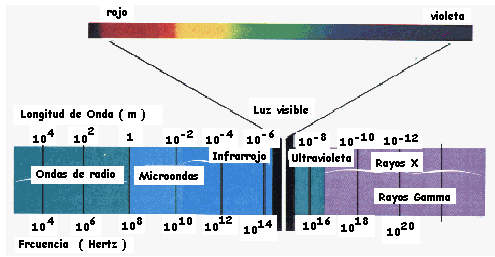
EL ESPECTRO CONTINUO DE ONDAS ELECTROMAGNÉTICAS
Al incidirlas ondas electromagnéticas sobre un prisma es posible separar las componentes según sus distintas frecuencias.
según la FISICA CLASICA
LA ENERGÍA ERA DE NATURALEZA CONTINUA
Y LA ENERGÍA DE UNA ONDA ELECTROMAGNÉTICA
ERA PROPORCIONAL A LA AMPLITUD DE LA ONDA.
Algunos experimentos cruciales
a) El espectro discontinuo de emisión del Hidrógeno

_
n cm-1
Según Ridberg la frecuencia de las señales está dada por la relación:
_
n = R H ( 1 / n2 - 1 / m2 ) RH = 109.677 cm –1
n y m enteros
b) El efecto fotoeléctrico.
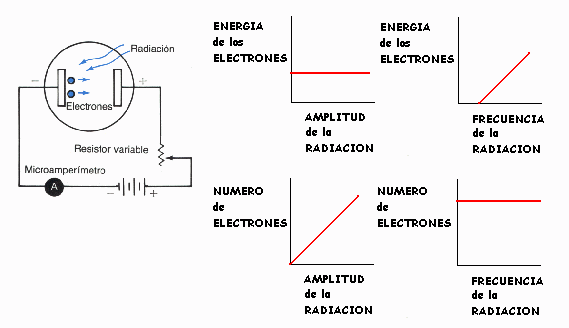
FÍSICA MODERNA
LA ENERGÍA ES DE CARACTER DISCONTÍNUO
SE PRESENTA A LA FORMA DE PEQUEÑOS
"PAQUETES DE ENERGÍA "
QUE SE DENOMINAN CUANTOS, CUANTAS O FOTONES
LA ENERGÍA DE UNA ONDA ELECTROMAGNÉTICA ES PROPORCIONAL A SU FRECUENCIA
ECUACIÓN DE MAX PLANCK
ENERGÍA DE UN FOTÓN = h n h = Constante de Planck = 6,62 10 -27 erg. seg
ENERGÍA DE UN FOTÓN = h n h = Constante de Planck = 6,62 10 -27 erg. seg
EL ATOMO DE HIDROGENO DE BOHR
(Principios Básicos de Química H.Gray)
1) Orbitas circulares
2) Momento angular = m e v r = n h / 2 p n = 1,2,3...........a
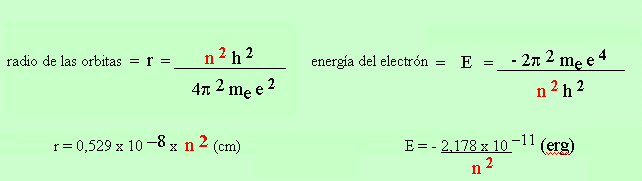
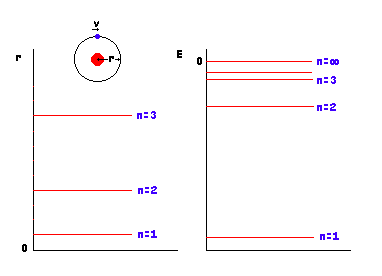
Ciertos valores de r Ciertos valores de E
u órbitas permitidas o niveles de energía permitidos
Energía asociada a los cambios de órbita 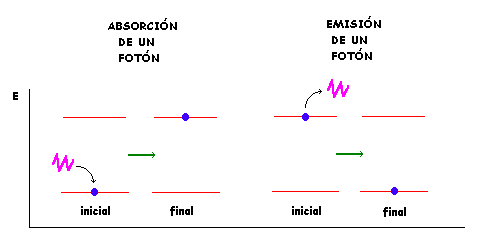


La formula anterior dá la frecuencia de los fotónes emitidos ( expresadas en Número de Ondas) para las transiciones de electrónicas de pérdida de energía en el átomo de Hidrógeno. Esta fórmula deducida a partir de consideraciones de discontinuidad de la energía ( Física Moderna) está en excelente acuerdo con la ecuación de Ridberg para el espectro discontinuo de emisión del átomo de Hidrógeno. Esta coincidencia en las expresiones fué un éxito para los postulados acerca de la energía de la Física Moderna y para el modelo atómico de Bohr. Sin embargo nuevos experimentos mostraron aspectos insatifactorios y la necesidad de otros modelos y explicaciones.
LA MECANICA CUANTICA ONDULATORIA
Efecto Compton
Efecto Compton
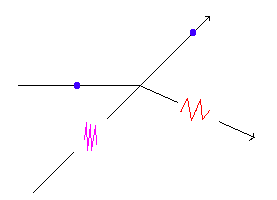
DUALISMO ONDA- PARTÍCULA
FOTÓN = ONDA | EFECTO COMPTON ==> | PARTÍCULA |
ELECTRÓN = PARTÍCULA | DIFRACCIÓN DE ELECTRONES (1927) ==> | ONDA |
DE BROGLIE " Todo cuerpo en movimiento tiene una onda asociada"
λ = h / m x v = h / p
Electrón, partícula – onda estacionaria .
PRINCIPIO DE INCERTIDUMBRE DE HEISSENBERG
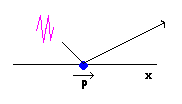
Es imposible conocer simultáneamente la posición x y el momento p de un electrón
D x D p = l . h / l = h > 0
ECUACION ONDA PARTÍCULA DE SCHRODINGER
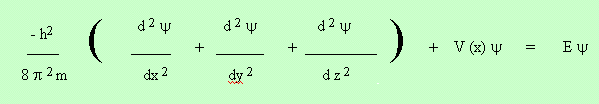
Ecuación diferencial de 2° orden para sistemas onda partícula, en tres dimensiones e independiente del tiempo donde:
h = constante de Planck,
y = Amplitud de la onda,
m = masa dela partícula
x,y,z = coordenadas de posición,
V(x,y,z ) = Energía Potencial,
E = Energía de la partícula
Resolver la ecuación es, lograr por integración, expresiones para:
y = f (x,y,z) ; E = g (x,y,z) y 2 a Probabilidad de encontrar la partícula en x,y,z
El encontrar, mediante el cálculo, las zonas de alta probabilidad de encontrar la partícula equivale a determinar los orbitales.
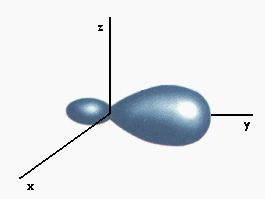
ORBITAL
ZONA DE ALTA PROBABILIDAD DE ENCONTRAR UNA PARTÍCULA
La Ecuación de Schorodinger se aplica al átomo de Hidrógeno y se resuelve obteniendo expresiones para y y E del tipo trigonométricas. En estas expresiones aparecen los denominados números cuánticos n, l, y m cuyas combinaciones se asocian a zonas de alta probabilidad de encontrar el electrón u orbitales.
LOS NUMEROS CUANTICOS, SU SIGNIFICADO,
SUS VALORES Y REGLAS DE COMBINACIÓNn = Número cuántico principal.
SUS VALORES Y REGLAS DE COMBINACIÓNn = Número cuántico principal.
Se asocia al tamaño y energia de los orbitales
¿Cuántos valores? infinito
¿Cuáles? 1,2 3,4,..............a ( Es el mismo n del átomo de Bohr)
l = Número cuántico secundario
Se asocia al tipo o forma de los orbitales
¿Cuántos valores? n
¿Cuáles? 0, 1, 2, 3, .........(n-1)
s p d f
Cada uno de los cuatro primeros valores se asocian respectivamente a las letras que se indican.
m = Numero cuántico magnético.
Se asocia con la orientación espacial de los orbitales
¿Cuántos valores? 2l +1
¿Cuáles? - l, - ( l-1 ), .... -1, 0, 1, ......+ ( l-1 ), + l
s = Numero cuántico de spín electrónico.
Se asocia al giro del electrón sobre su eje
¿Cuántos valores? 2
¿Cuáles? - 1 / 2 , + 1 / 2
COMBINACIONES DE NUMEROS CUANTICOS Y LOS ORBITALES n l m nl Número de Orbitales
1 0 0 1s 1
2 0 0 2s 1
1 - 1 2px 3
0 2py 1 2pz
3 0 0 3 1
1 -1 3px 3
0 3py 1 3pz
2 - 2 3d 5
-1 3d
0 3d 1 3d
2 3d
4 0 0 4s 1 1 -1 4px 3
0 4py 1 4pz
2 - 2 4d 5
- 1 4d
0 4d 1 4d
2 4d
3 - 3 4f 7
- 2 4f
- 1 4f
0 4f 1 4f
2 4f
3 4f
Se le sugiere construir el cuadro de combinaciones para n = 5
GRÁFICOS DE ORBITALES
Los orbitales px , py y pz
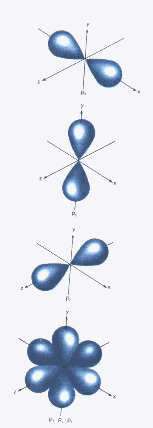
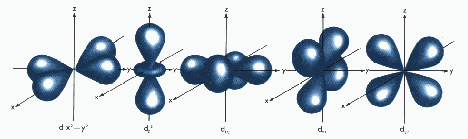
Los 5 orbitales d
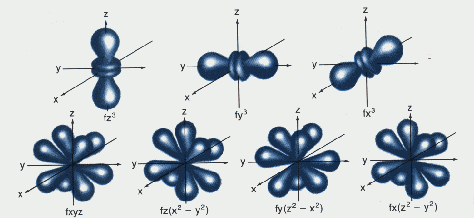
Los 7 orbitales f
ATOMOS POLIELECTRÓNICOS
Ante la imposibilidad de resolver la ecuación de Schorodinger para sistemas de varios electrones, se ha supuesto y con éxito, que sucesivos electrones adoptarán los diversos modos de vibración que se encontraron para el electrón de átomo de Hidrógeno.
En palabras más simples, los sucesivos electrones se ubicaran en los orbitales ya determinados para el átomo de Hidrógeno y de acuerdo a las siguientes reglas.
Principio de exclusión de Pauli
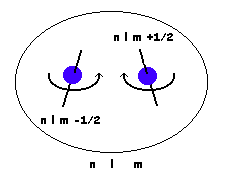
No puede haber 2 electrones con los 4 números cuánticos iguales. Es equivalente a establecer que un orbital acepta un máximo de 2 electrones.
Principio de Estabilidad o menor Energía
Regla de Ta o de las diagonales.Los electrones se ubican primero en los orbitales de menor energía.
Regla de Ta o de las diagonales.Los electrones se ubican primero en los orbitales de menor energía.
Son de menor energía los de menor valor de n + l.
A igualdad de n + l se considera de menor energía los de menor n.
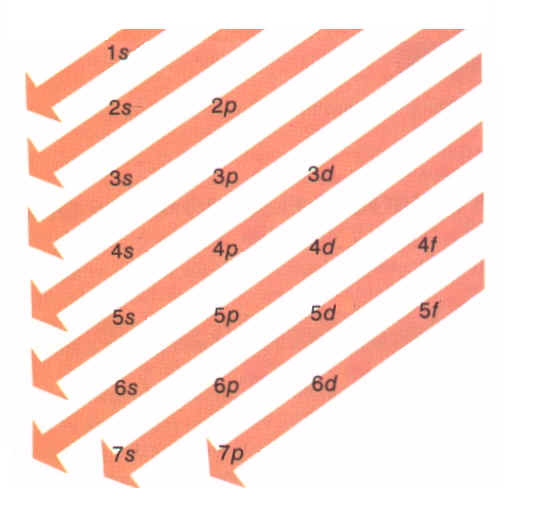
Diagonales indican el orden de llenado ( energía creciente)
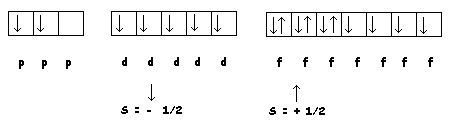
Principio de Hund
En el caso de varios orbitales de igual energía o "degenerados" ( igual n + l , igual n ), por ejemplo una serie de 3 orbitales p, o una serie de 5 orbitales d, o bién una de7 orbitales f. Los electrones entran de a uno en cada uno de ellos, haciéndolo primero, por convención, con spin negativo. Cuando todos los orbitales " degenerados" ya hayan recibido un electrón con spin negativo pueden formarse parejas de spines opuestos.
PROPIEDADES MAGNETICAS DE LAS SUSTANCIAS
Parece conveniente indicar en este momento que el principio de Hund promueve la situación que existan orbitales con un sólo electrón o electrón desapareado. Esta circunstancia tiene una importante consecuencia en las propiedades magnéticas de los elementos.Aquellas sustancias que poseen orbitales con electrones desapareados ( spin - 1/2) tienen propiedades paramagnéticas, esto es, los campos magnéticos de spín se suman, refuerzan o atraen los campos magnéticos externos, las sustancia son imantables.
De no suceder así, es decir, si todos los orbitales tienen electrones apareados ( spin + 1/2 y - 1/2 ) es una circunstancia que determina el diamagnetismo, la sustancia repele campos magnéticos externos y las sustancias no son imantables.
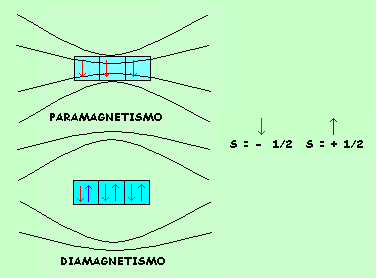
GRAFICO RESUMEN
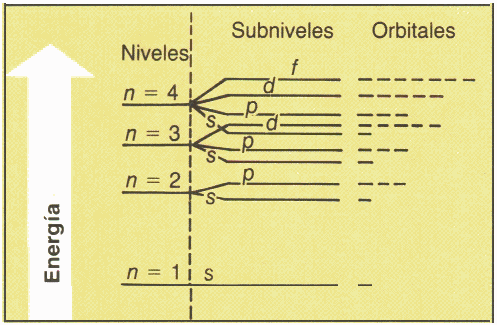
Diagrama para llenado electrónico, orbitales disponibles y en orden de energía creciente
CONFIGURACIONES ELECTRÓNICAS Y ELECTRONES DE VALENCIA
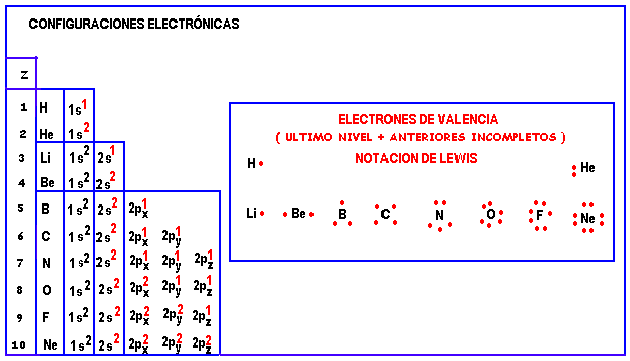
Los electrones de valencia son aquellos que se encuentran en los orbitales de mayor número cuántico principal más aquellos que están en orbitales con el número cuántico principal anterior al mayor a condición de estar incompletos.
SISTEMA PERIODICO DE LOS ELEMENTOS
Ubicación de los Números Atómicos por Configuraciones Electrónicas
Ubicación de los Números Atómicos por Configuraciones Electrónicas
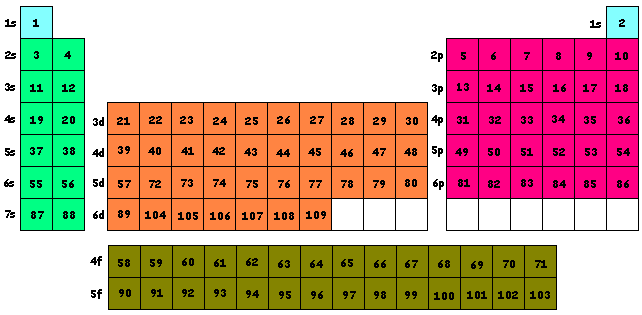
¿ Cuál es la configuración electrónica detallada del elemento cuyo Z = 77 ?
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 5d2 5d1 5d1 5d1
¿Cuales son electrones de valencia?
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d2 5d2 5d1 5d1 5d1
¿Cuales son los números cuánticos del último electrón ?
1s2 2s2 2p6 3s2 3p6 4s2 3d10 4p6 5s2 4d10 5p6 6s2 4f14 5d!¡ 5d!¡ 5d! 5d! 5d!
n= 5 l =2 m= -1 s = + 1/2
Unidad 4
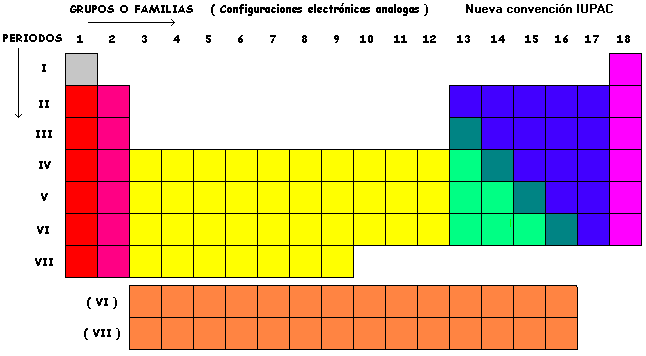
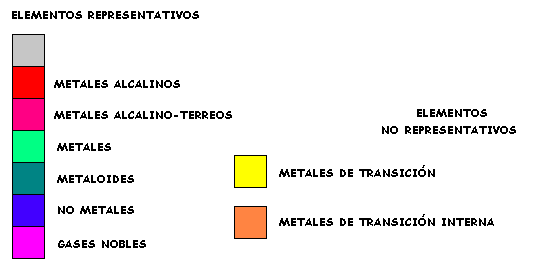
PROPIEDADES PERIODICAS DE LOS ELEMENTOS
CUADRO PERIÓDICO
PROPIEDADES PERIODICAS DE LOS ELEMENTOS
La repetición de las configuraciones electrónicas y la consiguiente conformación de un sistema de períodos y grupos es el fenómeno de carácter periódico más relevante. Sin embargo, hay otras propiedades atómicas importantes afectadas de carácter periódico.
El RADIO ATOMICO (R.A.)
Es la distancia entre el núcleo del átomo y el electrón periférico.
El siguiente gráfico muestra elocuentemente la variación periódica del Radio Atómico al avanzar el Número Atómico en los elementos. Se observa que los picks de mayor Radio Atómico corresponde a los metales alcalinos.
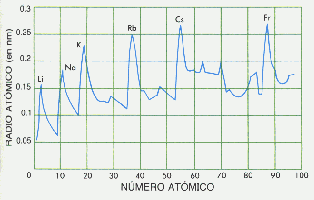
El RadioAtómico disminuye "suavemente" al Aumentar Z en un Período. Si bién los electrones están similar orbital, la carga positiva del nucleo se incrementa ejerciendo progresivamente mayor atracción sobre los electrones. Se muestra la situación observando los electrones periféricos (dibujados en amarillo) en orbitales 2p para elementos del 2° Período.
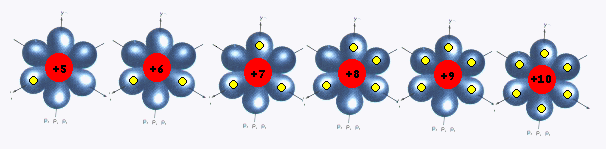
B C N O F Ne
El Radio Atómico aumenta "bruscamente" al aumentar Z en un Grupo o familia. Los electrones periféricos se encuentra en un orbital del mismo tipo pero en el nivel siguiente. Para comprender la situación hay que recordar que, por un lado, el radio de la órbita en el átomo de Bohr o volumen del orbital en el átomo de Hidrógeno es proporcional al cuadrado de n. Por otro lado, también hay que tener presente que el aumento de Z significa mayor atracción sobre los electrones. Predomina el primer efecto pero atenuado por el segundo factor.
Los iones son atomos cargados eléctricamente que resultan de ganar o perder electrones.El Radio de lo iones es diferente al de los atomos neutros. Los iones negativos ( ganan electrones) son de mayor Radio, en cambio los positivos, ( pierden electrones) son menor Radio.
Diagrama de radios atómicos y radios iónicos
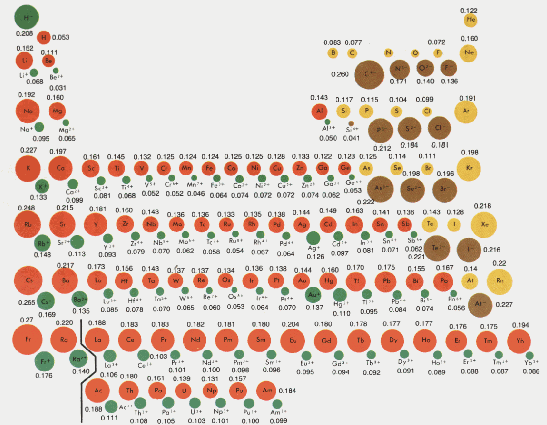
tomado del Merrill Química (Smoot,Price,Smith pág 183 )
Las estructuras isoelectrónicas, son iones positivos o negativos o bien átomos neutros que poseen igual configuración electrónica ( igual número de electrones ). Puede pensarse, que por ésta razón, el Radio de las estructuras isoelectrónicas debe ser el mismo. No es así, pues, al igual que acontece con la disminución de los radios en un Período, la carga positiva en el nucleo es diferente. A mayor Z menor Radio.
__________________>
Menor Radio
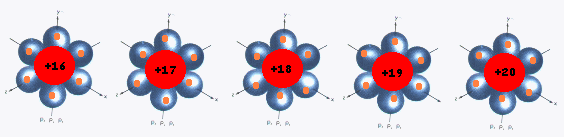
S –2 Cl -1 Ar 0 K + Ca +2EL POTENCIAL DE IONIZACIÓN ( P . I .)
Es la Energía que se necesita para arrancar el electrón periférico a un átomo neutro libre.
A 0 (g) + POTENCIAL DE IONIZACIÓN = A+ 1 (g) + e-
Mientras más cercano al nucleo, el electrón periférico es atraído con mayor fuerza y viciversa. En consecuencia la magnitud de la Energía de Ionización se comporta en forma inversa a la del Radio Atómico.
LA ELECTROAFINIDAD ( E . A .)
Es la Energía que se libera cuando un átomo libre y neutro capta un electrón .
A 0 (g) + e- = A-1 (g) + ELECTROAFINIDAD
Mientras más cercano al nucleo, el electrón periférico es atraído con mayor fuerza y viciversa. En consecuencia la magnitud de la Electroafinidad se comporta en forma inversa a la del Radio Atómico .
Es la Energía que se necesita para arrancar el electrón periférico a un átomo neutro libre.
A 0 (g) + POTENCIAL DE IONIZACIÓN = A+ 1 (g) + e-
Mientras más cercano al nucleo, el electrón periférico es atraído con mayor fuerza y viciversa. En consecuencia la magnitud de la Energía de Ionización se comporta en forma inversa a la del Radio Atómico.
LA ELECTROAFINIDAD ( E . A .)
Es la Energía que se libera cuando un átomo libre y neutro capta un electrón .
A 0 (g) + e- = A-1 (g) + ELECTROAFINIDAD
Mientras más cercano al nucleo, el electrón periférico es atraído con mayor fuerza y viciversa. En consecuencia la magnitud de la Electroafinidad se comporta en forma inversa a la del Radio Atómico .
No cuenta para los gases nobles
LA ELECTRONEGATIVIDAD ( E. N.)
La Electronegatividad es una magnitud que engloba tanto al P.I como a la E.A. y, en consecuencia, es proporcional a ambas. De la misma forma que las magnitudes anteriores se comporta en forma inversa al Radio Atómico
Mide la tendencia a formar iones negativos o bien la capacidad de atraer electrones.
LA ELECTRONEGATIVIDAD ( E. N.)
La Electronegatividad es una magnitud que engloba tanto al P.I como a la E.A. y, en consecuencia, es proporcional a ambas. De la misma forma que las magnitudes anteriores se comporta en forma inversa al Radio Atómico
Mide la tendencia a formar iones negativos o bien la capacidad de atraer electrones.
La electronegatividad máxima es la del Fluor e igual a 4. No cuenta para los gases nobles.
LA ELECTROPOSITIVIDAD ( E . P .)
La Electropositividad es una magnitud de sentido inverso de la E. N.
Mide la tendencia a formar iones positivos o bien la capacidad de perder, ceder o repeler electrones.
LA ELECTROPOSITIVIDAD ( E . P .)
La Electropositividad es una magnitud de sentido inverso de la E. N.
Mide la tendencia a formar iones positivos o bien la capacidad de perder, ceder o repeler electrones.
Tampoco cuenta para los gases nobles
RESUMEN
RESUMEN
TENDENCIAS DE LAS MAGNITUDES
DE LA PROPIEDADES EN EL SISTEMA PERIODICO
MAS INFORMACIÓN ACERCA DEL SISTEMA PERIÓDICO Y DE LOS ELEMENTOS
LA FORMACIÓN DE LOS IONES
Las propiedades periódicas recién estudiadas y sus variaciones en el ordenamiento del Sistema Periódico apuntan a un hecho de singular importancia para el comportamiento químico de los distintos elementos. Esta es la situación de estabilidad, sinónimo de baja energía, de los sistemas electrónicos de los gases nobles. Estos sistemas tienen sus orbitales comprometidos, completos de electrones. La circunstancia que las moléculas de gases nobles son monoatómicas son la prueba de tal estabilidad, es decir, los átomos de los gases nobles no realizan intercambios electrónicos ni para formar iones ni para unirse con otros átomos pues sus configuraciones electrónicas son estables.
Tal concepto es reafirmado y a la vez explica el comportamiento de los átomos de los otros elementos. Estos realizan transferencias electrónicas para formar iones o formar moléculas de tal forma de alcanzar la configuración electrónica del gas noble más cercano. El tener niveles o subniveles electrónicos completos de electrones caracteriza el comportamiento de intercambio electrónico de los átomos de los distintos elementos.
Es así que los atomos ganan o pierden determinadas cantidades de electrones para completar niveles o subniveles alcanzando ciertas cargas eléctricas o estados de oxidación.
A continuación se señalan los estados de oxidación para átomos de elementos de presencia más corriente en un ordenamiento de grupos que, en parte, recuerda al del Sistema Periódico.
A continuación se señalan los estados de oxidación para átomos de elementos de presencia más corriente en un ordenamiento de grupos que, en parte, recuerda al del Sistema Periódico.
H +1 (-1) He0
Li +1 Be +2 B+3 C -4+2+4 N –3 (+1)+3 (+4)+5 O –2 F -1 Ne0
Na+1 Mg+2 Al+3 Si -4+2+4 P –3+3+5 S –2+2+4+6 Cl -1+1+3+5+7 Ar0
K +1 Ca +2 Br -1+1+3+5+7 Kr0
Rb+1 Sr +2 I -1+1+3+5+7 Xe0
Cs+1 Ba +2 Cr+3+6 Mn +2+4+6+7 Fe +2+3 Co+2 Ni +2 Cu (+1) +2 Zn +2 Rn0
Fr +1 Ra +2 Hg (+1)+2 Cd +2 Ag+1 Au +1+3 Pb +2+4 Sn+2+4
LA FORMACION DE LAS MOLECULAS
La formación de los iones o bién alcanzar ciertos estados de oxidación hay que observarlo como un proceso asociado entre distintos átomos y que conduce a la formación de las moléculas de las diferentes Sustancias Puras. Las fórmulas (atomicidades) de aquellas moléculas puede deducirse teniendo en cuenta el estado de oxidación de los iones estabilizados y fundamentalmente la necesidad que la estructura molecular resultante sea eléctricamente neutra. La atomicidad de un elemento se obtiene tomando en primer término el valor absoluto del estado de oxidación del átomo del otro elemento y viciversa, luego aquellas atomicidades se simplifican, de ser posible, llegándose a las definitivas.
M+m n N -n m
M = Metal N = No Metal
TIPOS DE COMPUESTOS FUNDAMENTALESSU OBTENCIÓN FORMAL Y DENOMINACIÓN ACTUAL Y ANTIGUA
OXIDOS METALICOS M 0 + O 0 2 ________ > M +m 2 O –2m
Ejemplos: Cu +12 O –2 Oxido de cobre I , antes Oxido cuproso
Cu +2 O –2 Oxido de cobre II , antes Oxido cúprico
OXIDOS NO METALICOS ( antes ANHIDRIDOS)
N 0 + O 0 2 _________> N +n2 O –2n
Ejemplos: C +2 O –2 Oxido de carbono II , antes Anhidrído carbonoso
N 0 + O 0 2 _________> N +n2 O –2n
Ejemplos: C +2 O –2 Oxido de carbono II , antes Anhidrído carbonoso
C +4 O –22 Oxido de carbono IV, antes Anhidrído carbónico
Como se puede observar, la denominación antigua que es muy persistente, depende del Número de Oxidación con que interviene el elemento. Esta nomenclatura usa prefijos y terminaciones alrededor de la raíz del nombre del elemento de acuerdo al número de estados de oxidación que posee el elemento y a la posición, entre éstos, del número de oxidación en uso.
Así:
Número de estados 1 2 3 4
de Oxidación
hipo ------ oso hipo ------ oso
------- ------oso ------ oso ------ oso
-------ico ------ ico ------ ico
per ------ ico
------- = raíz del nombre del elemento
LOS HIDRÓXIDOS (OXIDO METALICO+ AGUA) M +m2 O -2m + m H+12 O-2 = 2 M+m ( O-2 H+1)m
Ejemplo:
Al +32 O -23 + 3 H+12 O-2 = 2 Al+3 ( O-2 H+1)3 ( Al ( OH)3 )
Oxido de Aluminio Hidróxido de Aluminio
LOS OXACIDOS ( OXIDO NO METALICO + AGUA) N +n 2 O -2n + H+12 O -2 = H+12 N+n2 O-2n+1
LOS OXACIDOS ( OXIDO NO METALICO + AGUA) N +n 2 O -2n + H+12 O -2 = H+12 N+n2 O-2n+1
Ejemplo:
S+6 O-2 3 + H+12 O–2 = H+12 S+6 O-24 ( H2 S O4 )
Anhídrido Sulfúrico Acido Sulfúrico
LOS HIDRACIDOS (HIDROGENO +NO METALES) n H 02 + N 02 = 2 H+1n N – n
Ejemplo:
n H 02 + S 02 = 2 H+12 S – 2 ( H2 S )
Acido Sulf hídrico
LOS ACIDOS Y LAS BASES Mejor que un nuevo tipo de compuestos habría que señalar que son compuestos que poseen una propiedad relacionada a la reacción de disociación del agua y a los iones que allí son liberados:
H2O
H2O = H + + OH –
ión hidrógeno ión hidroxilo
ACIDOS son sustancias de fórmula general HA que se disocian en agua liberando el ión hidrógeno H2O
ACIDOS son sustancias de fórmula general HA que se disocian en agua liberando el ión hidrógeno H2O
HA = H + + A –
ácido ión hidrógeno anión del ácidoAsí se comportan los oxácidos y los hidrácidos:
Ejemplos:
H 2 S O 4 = 2 H + + SO4 –2 Ácido sulfúr ico Anión sulf ato (1)
Observar como la denominación del ácido se transforma para el anión
oso _____________> ito
ico _____________> ato
H 2 S = 2 H + + S –2
Ácido sulf hídrico Anión sulf uro
Observar como la denominación del ácido se transforma para el anión hídrico ___________> uro
BASES son sustancias de fórmula general BOH que se disocian en agua liberando el ión hidroxilo.
H20
BOH = B + + OH –
base catión de la base ión hidroxilo Así se comportan los hidróxidos:
Ejemplo:
u ( O H ) 2 = Cu+2 + 2 OH -
catión cúprico (1)
- Anión es un ión de carga negativa y Catión es un ión de carga positiva. Los nombres provienen de la Electroquímica
LAS SALES ( RESULTADO DE LA REACCION DE ACIDOS + BASES)OXÁCIDOS + BASES = SAL + AGUA
m H+12 N+n2 O-2n+1 + 2 M+m ( O H )- m = M+m2 ( ( N+n2 O-2n+1 ) –2)m + 2m H2OEjemplo:
3 H+12 S+6 O -24 + 2 Al+3 ( O H)-3 = Al+32 ((S+6 O –24) -2)3 + 6 H2O
( 3 H2 S O4 + 2 Al ( O H) 3 = Al 2 (S O4) 3 + 6 H2O )
Acido Sulfúrico Hidróxido de Aluminio Sulfato de Aluminio AguaHIDRACIDOS + BASES = SAL + AGUA m H+1n N – n + n M+m ( O H )– m = M+mn N – nm + mn H 2 O
Acido Sulfúrico Hidróxido de Aluminio Sulfato de Aluminio AguaHIDRACIDOS + BASES = SAL + AGUA m H+1n N – n + n M+m ( O H )– m = M+mn N – nm + mn H 2 O
Ejemplo:
H+12 S–2 + 2 Al+3 ( O H ) -3 = Al +32 S– 23 + 6 H 2 0
( H2 S + 2 Al (OH )-3 = Al2 S3 + 6 H 2 0 )
Acido Sulfhídrico Hidróxido de Aluminio Sulfuro deAluminio Agua
LOS HIDRUROS ( IONES METALICOS CON IONES HIDRUROS)
M0 + m /2 H02 = M+m H -m
Ejemplo:
Mg0 + H02 = Mg+2 H–2 ( Mg H2 )
Hidruro de Magnesio
UNIDAD 5
ENLACE QUIMICO
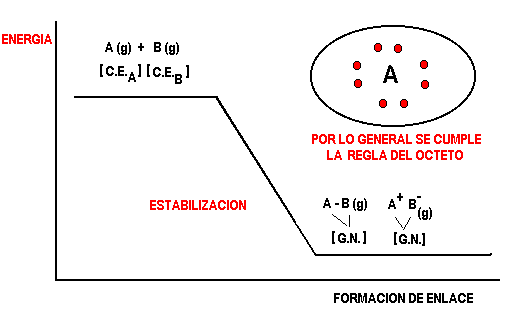
El enlace químico es la fuerza que une a los atomos para formar las moléculas.
Como ya se ha dicho es un proceso de estabilización por interacciones electrónicas donde cada átomo trata de alcanzar la configuración electrónica del gas noble más cercano. Por lo general los gases nobles tienen 8 electrones de valencia, de allí se acostumbra a decir que el enlace químico se forma cumpliendo la "regla del octeto".
La energía de estabilización se denomina también laenergía de enlace y corresponde además de la energía liberada cuando se forma el enlace a laenergía necesaria para romper el enlace.
Aquí es conveniente repasar el concepto deelectrones de valencia y su representación mediante la notación de Lewis.
Los electrones de valencia son aquellos que se encuentran en los orbitales de mayor número cuántico principal más aquellos que están en orbitales con el número cuántico principal anterior al mayor a condición de estar incompletos.
TIPOS DE ENLACES Y POLARIDAD DE LOS ENLACES
Existen dos mecanismos para cumplir la regla del octeto.
- ENLACE IONICO. Cesión de electrones, de parte de un átomo fuertemente electropositivo a otro fuertemente electronegativo. Formación de iones positivos y negativos y atracción electrostática entre ellos.
- ENLACE COVALENTE. Compartición de parejas de electrones entre átomos de parecida o igual electronegatividad. Electrones compartidos con spines opuestos y atracción magnética.
Ejemplos de estas situaciones, donde se muestra la estructura electrónica a nivel molecular, se dan a continuación mediante las correspondientes notaciones de Lewis.
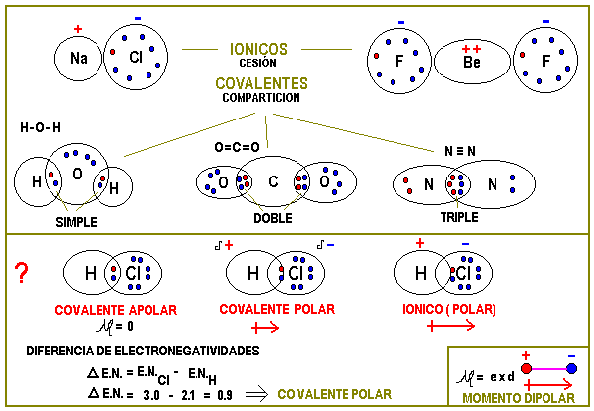
En la segunda parte de gráfico precedente se muestra como un enlace covalente deviene en covalente polar y luego en iónico polar simplemente al crecer la asimetría de la posición de la pareja de electrones compartida.
A continuación una visión total, o sea las diferentes situaciones en función de la diferencia de electronegatividad entre los átomos involucrados.

TIPOS DE ENLACES Y UNIONES
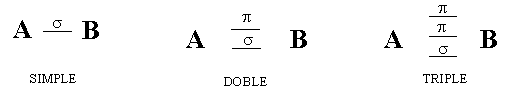
| CUADRO COMPARATIVO DE ENERGÍAS Y LONGITUDES DE ENLACE |
| ENLACES | C-C | C = C | H - H | C - H | C - O | C = O |
| ENERGÍAS DE ENLACE Kcal/mol | 83 | 146 | 200 | 104 | 99 | 85 | 179 |
| LONGITUDES DE ENLACE A° | 1,54 | 1,35 | 1,2 | 1,07 | 1,43 | 1,22 |
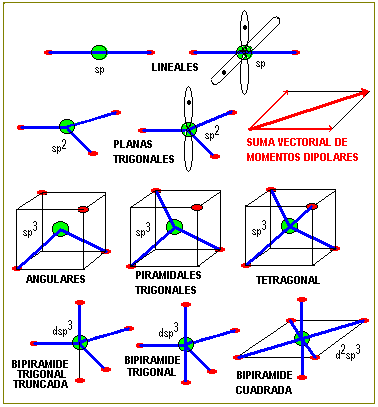
GEOMETRÍA MOLECULAR
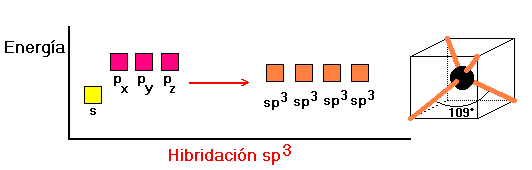
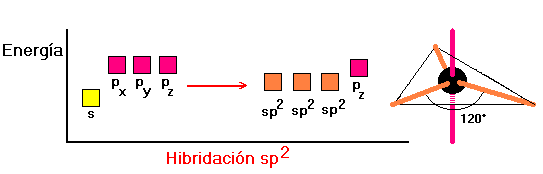
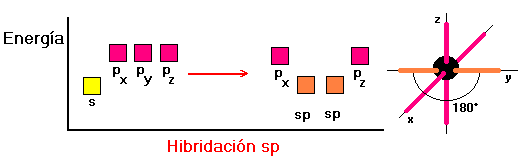
LA HIBRIDACIÓN DE ORBITALES
La disposición de los átomos en el espacio se determina experimentalmente mediante la técnica de difracción de rayos X. Para hacer concordar la información experimental con aspectos teóricos se ha visto la necesidad de formular un modelo de reordenamiento posicional de los orbitales atómicos. Esta formulación de orden matemático se conoce como hibridación de los orbitales atómicos(mezcla matemática de funciones de onda).
LA HIBRIDACIÓN DE ORBITALES
La disposición de los átomos en el espacio se determina experimentalmente mediante la técnica de difracción de rayos X. Para hacer concordar la información experimental con aspectos teóricos se ha visto la necesidad de formular un modelo de reordenamiento posicional de los orbitales atómicos. Esta formulación de orden matemático se conoce como hibridación de los orbitales atómicos(mezcla matemática de funciones de onda).
Existen diferentes formas de hibridación y la forma que en definitiva adopte un átomo decidirá la orientación espacial de sus orbitales y por consecuencia la GEOMETRIA MOLECULAR .
Veamos las hibridaciones más simples.
CRITERIOS PARA DECIDIR LA HIBRIDACIÓN
1:- CRITERIO MULTIPLICIDAD DE LOS ENLACES
Hay que observar la multiplicidad de los enlaces, esto es, cuántas uniones pi deben formarse. Para cada unión pi un átomo debe disponer un orbital p.
Dos uniones pi obligan a un átomo a tener 2 orbitales p, o sea que, la hibridación debe ser sp.
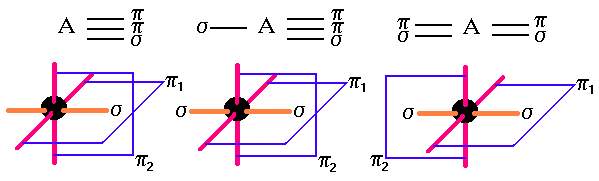
Una unión pi requiere un orbital p. Por lo tanto el átomo puede tener hibridación sp o sp2,pero no sp3 (esta no tiene orbitales p). La ambigüedad se resuelve mediante el siguiente criterio complementario.
2.-CRITERIO DE REPULSIÓN DE PAREJAS DE ELECTRONES
Las parejas de electrones, ya sean enlazantes o bién no enlazantes, se repelen por tener igual carga. Entonces el criterio obliga a dar el máximo ángulo de separación a todas las parejas de electrones.
En los graficos siguientes los electrones del átomo cuya hibridación tratamos de determinar los representamos como puntos azules y los electrones del átomo vecino con el que se enlaza como puntos rojos. Así, las parejas enlazantes se grafican como puntos azul y rojo indicando electrones que pertenecen al átomo en cuestión y al otro átomo respectivamente y las no enlazantes del átomo como un par de puntos azules.
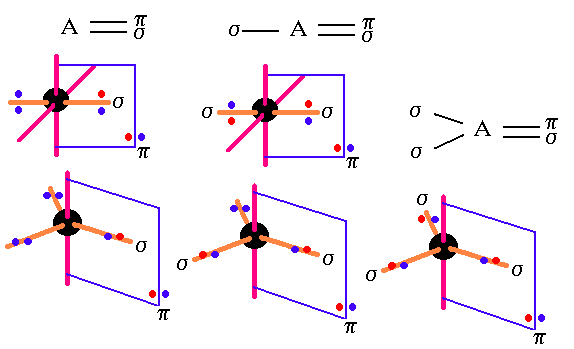
Como se puede observar, si el número de parejas de electrones alrededor de un átomo es tres la hibridación es sp,
En cambio, si el número de parejas de electrones escuatro la hibridación es sp2.
Cuando existen solamente uniones s la hibridación se determina sólo en base del criterio de repulsión de parejas.
Cuando hay sólo una unión s no hay hibridación.
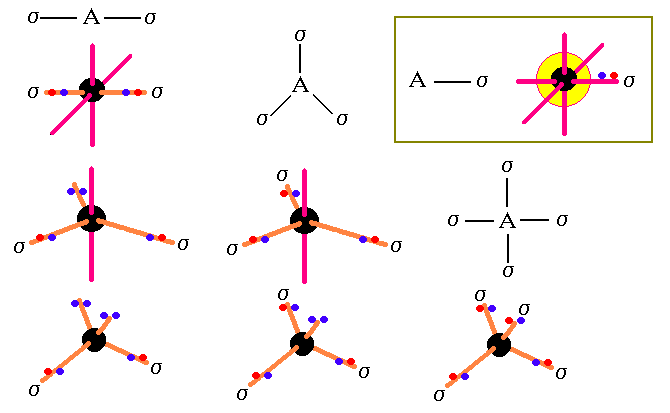
Dos parejas de electrones la hibridación es sp , tresparejas de electrones la hibridación es sp2 y cuatroparejas de electrones la hibridación es sp3 .
OTRAS HIBRIDACIONES Y LAS PRINCIPALES GEOMETRIAS MOLECULARE
LA LONGITUD Y LA ESTABILIDAD DE LOS ENLACES DE ATOMOS HIBRIDIZADOS.
Puesto que los orbitales s son pequeños y de baja energía comparados con los orbitales p que son de mayor alcance y mayor energía, los enlaces de átomos hibridizados mantendrán aquellas características según el grado de carácter s o p tenga cada situación.
Tipo de enlace (simple) | Caracter s (%) | Radio Covalente Medio ( A°) | Longitud de Enlace (A°) | Estabilidad |
Cp -Cp | 0 % | - | + | |
Csp3 - Csp3 | 25 % | 0,763 | 0,763+0,763 = 1,526 | ++ |
Csp3 - C sp2 | 0,763+0,743 = 1,506 | +++ | ||
Csp3 - C sp | 0,763+0,691 = 1,454 | ++++ | ||
Csp2 - C sp2 | 33,3 % | 0,743 | 0,743+0,743 = 1,486 | +++++ |
Csp2 - C sp | 0,743+0,691 = 1,434 | ++++++ | ||
Csp - C sp | 50 % | 0,691 | 0,691+0,691 = 1,382 | +++++++ |
PROPIEDADES FISICOQUIMICAS
DE LAS SUSTANCIAS PURAS
Los tipos de enlaces, la direccionalidad de éstos, los rasgos eléctricos y otras características moleculares determinan las propiedades fisicoquímicas de las sustancias.
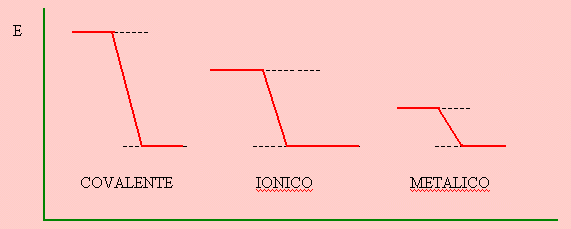
Parece conveniente referirse en éste momento a la fortaleza comparada de los distintos tipos de enlaces interatómicos. La fortaleza del enlace está dada por la energía necesaria para romper el enlace y ésta a su vez es directamente proporcional a la energía de estabilización o energía liberada cuando el enlace se forma.
El enlace covalente es el más fuerte, lo sigue el iónico y finalmente el metálico que es el más débil.
A continuación trataremos de visualizar las distintas categorías de sustancias y sus propiedades fisicoquímicas principales.
MOLECULAS GIGANTES
Son arreglos de átomos, unidos mediante fuerzas de enlace químico (interatómico), en que no está definido el tamaño del sistema. Por lo general son arreglos de gran tamaño y de allí el nombre de la categoría. La proporción de distintos átomos se conoce y se representan estos sistemas por su fórmula empírica. La fórmula verdadera es (F.E.) n , pero n es indeterminada.
Hay tres grandes tipos de moléculas gigantes, las de enlace iónico, las de enlace covalente y las de enlace metálico.
COVALENTES TRIDIMENSIONALES
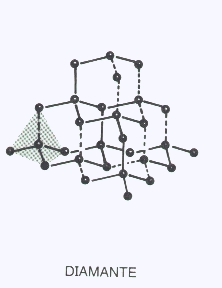
Son arreglos tridimensionales de átomos iguales o diferentes unidos por enlaces covalentes y dispuestos en el espacio siguiendo las reglas de la hibridación. Son las estructuras más rígidas, duras o resistentes que se conocen.
Sus temperaturas de fusión son muy altas ( miles de°C) y en muchos casos se descomponen químicamente por el calor antes de entrar en fusión. Por otra parte la separación de las partículas por acción de moléculas de un solvente es imposible, por lo tanto son completamente insolubles.
El Carbono en su forma de diamante ( hibridación sp3 ) es un ejemplo típico de ésta categoría. Las láminas de Silicio de la nariz del Discovery son otro ejemplo.
COVALENTES BIDIMENSIONALES
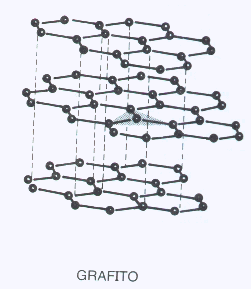
Es cuando la red de enlaces covalentes se teje en dos dimensiones. Los mismos conceptos de infusibilidad e insolubilidad que para las mallas trididimensionales pero no así en lo que se refiere a la dureza pues las fuerzas de atracción entre las mallas bidimensionales es débil. Por esa razón estas sustancias son blandas en el sentido del desprendimiento de las mallas.
El ejemplo típico es el Carbono en su forma de grafito en que los C están hibridizados sp2 . Es interesante consignar que en cada orbital pzexisten un electrón. Estos electrones se pueden desplazar sobre la malla y en consecuencia el grafito es conductor de la corriente eléctrica.
COVALENTES UNIDIMENSIONALES
Corresponde a las sustancias denominadaspolímeros, largas cadenas de unidades conectadas por enlaces covalentes.
Los homopolímeros que repiten unidades iguales (-A-A-A-A-A-A- ; -(A)- n ).
Los copolímeros que repiten unidades distintas ( A-B-A-B-A-B- ; ( -A-B-) n ).
Son cadenas largas llamadas tambiénmacromoléculas y por ésta razón es que interaccionan unas con otras de manera significativa. Las interacciones entre macromoléculas son fuerzas de distintos tipos y que veremos más adelante en el caso de moléculas pequeñas.
En los polímeros, en primer término, la fusión y la solubilización están determinadas por la magnitud de las fuerzas de atracción entre las macromoléculas, en principio altas, precisamente por la longitud de las cadenas. Sin embargo, existe un segundo factor determinante, el factor entrópico o desorden que pueden alcanzar las estructuras una vez solubilizadas o fundidas.
Los polímeros flexibles o plegables forman estructuras sólidas bifásicas (cristalinas – amorfas) que son quebradizas, éstas estructuras se pueden disolver o fundir con relativa facilidad pues cuando alcanzan tales estados la macromoléculas están muy enroscadas, plegadas u ovilladas, en suma desordenadas lo que favorece el proceso de separación de las macromoléculas.
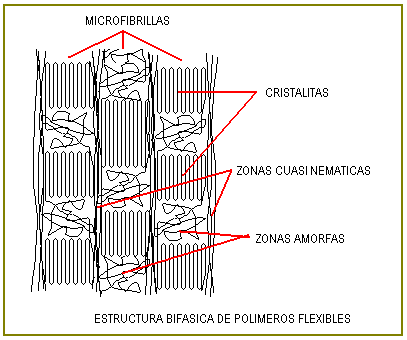
En cambio, las macromoléculas rígidas no tienen favorable el factor entrópico y así son dificiles de fundir y solubilizar. Estos polímeros rígidos, en el sólido son monofásicos y de mucha resistencia ( Kevlar).
En la práctica un gran número de macromoléculas se encuentran entre estas dos situaciones extremas y el grado de endurecimiento o ablandamiento depende de las temperaturas a que se encuentran sometidos los sistemas.
Los procesos de ablandamiento sobrevienen en zonas de temperaturas bien definidas para cada tipo de macromoléculas.
Muchas veces las cadenas macromoléculares sintéticas o naturales se conectan entre sí mediante átomos o grupos de átomos enlazados covalentemente ( polímeros reticulados) con propósitos tecnológicos precisos. En estos casos las estructuras resultantes semejan a las redes covalentes bi o tridimensionales y así también son sus propiedades, nula solubilidad y puntos de fusión demasiado elevados que amenazan la estabilidad química de las sustancias.
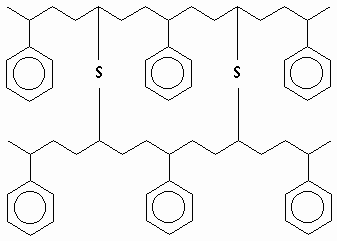
Copolímero de estireno-butadieno (neumáticos) vulcanizado con S.
Este tipo de productos son difíciles de recuperar y reutilizar ( Reciclaje) precisamente por las razones ya mencionadas y constituyen un problema para la ecología por la contaminación del ambiente.
La celulosa es un polímero natural de características estructurales semirígidas y si a ello agregamos que entre las cadenas macromoleculares existen fuerzas de atracción, de alta magnitud como los puentes de H debido a la presencia de mucho grupos de -OHson comprensibles las dificultades para la fusión y la solubilización.

Estructura tipo celulosa
IONICAS.
En estas moléculas gigantes los átomos están unidos por enlaces iónicos. Es decir son un arreglo de iones positivos y negativos que se disponen alternadamente en el espacio compensando sus cargas . La geometría del arreglo es simple cuando los iones positivos y negativos son monoatómicos y además se encuentran en relación 1:1 como en el caso del Na+Cl -. Cuando los iones son complejos, con grandes diferencias de tamaños o la proporción entre ellos no es simple, los arreglos son complicados y son materia de estudio de la Cristalografía que hace uso de las técnicas de difracción de rayos X para resolver estas situaciones.
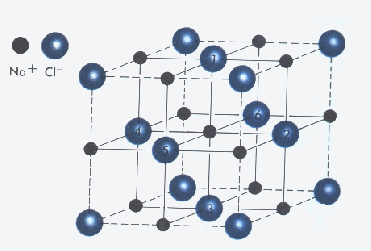
Son estructuras de temperatura de fusión elevadas , alrededor de los 1000°C de acuerdo a la fortaleza del enlace iónico. En estado sólido o cristalino, donde los iones se encuentran atrapados no conduce la corriente eléctrica, pero sí la conducen en estado fundido.
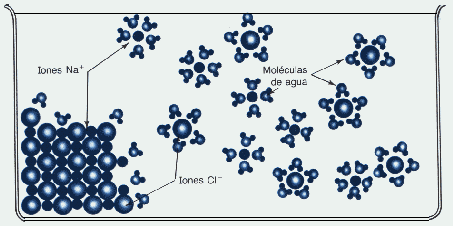
Estas estructuras pueden ser solubilizadas, aunque no siempre, mediante solventes con moléculas polares como el caso de agua. Las moléculas del solvente rodean los iones apuntando sus fracciones de carga al ión de carga opuesta. Así los iones solvatados son separados al debilitarse el enlace iónico. De ésta forma los iones disueltos (móviles) constituyen partículas para el flujo eléctrico.
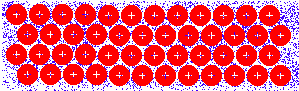
METALICAS
Corresponde al caso de los metales. Los átomos metálicos , al ser muy electropositivos se desprenden de sus electrones de valencia pasando a formar iones positivos. Por su parte los electrones que han perdido su pertenencia a un átomo determinado se mueven entre los iones constituyendo una nube de electrones delocalizados. Esta nube de electrones que une a iones positivos es el enlace metálico.
Ya nos hemos referido a la fortaleza del enlace metálico y podemos generalizar diciendo que los puntos de fusión de los metales son medianamente altos. Señalemos que metales como el Hg, Cs, y Fr son líquidos a temperatura ambiente.
La naturaleza de movilidad del enlace metálico confiere a los metales su blandura, es decir los convierte en dúctiles y maleables.
La movilidad de los electrones se traduce en la capacidad de conducción de la corriente eléctrica y también es responsable de la conductividad térmica.
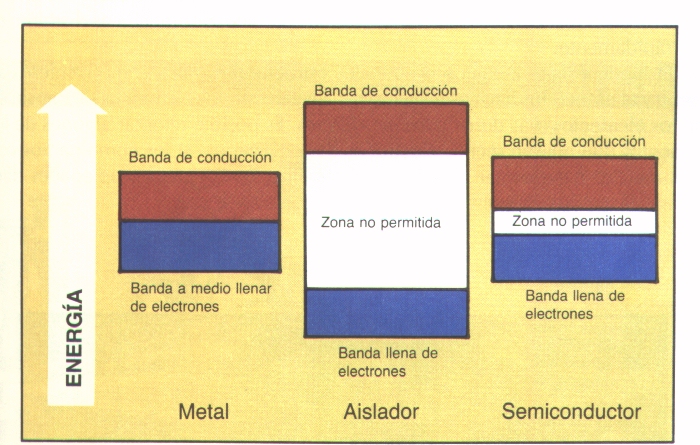
Es interesante observar la relación entre las conductividades eléctricas y térmicas y la situación de los diagramas de energía de los orbitales llenos y vacíos de metales y no metales. Los metales promueven sus electrones de valencia de orbitales s a los orbitales p vacíos que se encuentran energéticamente cercanos formando éstos últimosorbitales o bandas de conducción. Por el contrario, los no metales tienen los electrones en orbitales p y los orbitales s siguientes vacíos se encuentran energéticamente lejanos por lo que no se produce la promoción y los electrones permanecen ligados a sus respectivos átomos.
MOLECULAS CONVENCIONALES
O SUSTANCIAS MOLECULARES
Son aquellos sistemas formados por moléculas que se encuentran claramente definidas, se conoce el número exacto de átomos y de qué elementos está constituída la molécula. Se representan por las llamadas fórmulas moleculares reales.
En su gran mayoría las moléculas de ésta categoría unen sus átomos con enlaces covalentes y al expresar esto pensamos en muchas moléculas simples formadas entre no metales y en la inmensa cantidad de compuestos orgánicos constituídos principalmente por los elementos C, H, O, N, P, S.
Sin embargo al momento de racionalizar las propiedades fisicoquímicas de este tipo de estructuras, el tipo de enlace interatómico ( covalente) y su fortaleza no cuenta pués en este caso lo determinante son las fuerzas entre moléculas o fuerzas intermoleculares y en algunos casos sonfuerzas intramoleculares ( fuerzas dentro de las moléculas; pero no interatómicas o de enlace químico ) las determinantes de las propiedades.
En todo caso las fuerzas intermoleculares son de naturaleza eléctrica, pero las hay de diferente naturaleza y magnitudes pero siempre dependen en definitiva de las características eléctricas, del tamaño y geometría de las moléculas.
En los comentarios generales cabe señalar que estos sistemas no conducen la corriente eléctrica en ningún estado físico y también son malos conductores del calor.
FUERZAS INTERMOLECULARES
| TIPO MOLECULAR | FUERZA | MAGNITUD | FENÓMENO | SOLUBILIDAD | PUNTO DE FUSIÓN Y EBULLICIÓN |
| APOLAR | VAN DERWAALS | DEBIL | POLARIZABILIDADELECTRONICA | SOLVENTE APOLAR | MUY BAJOS |
| POLAR | ATRACCIÓNDIPOLO-DIPOLO | MEDIANA | POLARIDAD MOLECULAR PERMANENTE | SOLVENTE POLAR | BAJOS |
| ____ X - H( X= F, O, N ) | PUENTEHIDROGENO | FUERTE | POLARIDAD PERMANENTE LOCALIZADA | SOLVENTEPOLAR | MEDIANOS |
EFECTOS COMPARADOS DE DISTINTAS FUERZAS INTERMOLECULARES SOBRE LAS TEMPERATURAS DE EBULLICIÓN
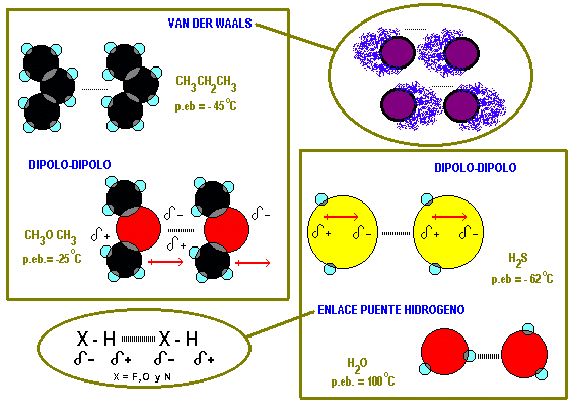
Las fuerzas de Van der Waals son comparativamente las fuerzas intermoleculares de menor intensidad pero pueden existir grandes diferencias de sus magnitudes entre moléculas que las poseen como único factor de atracción.
Estas diferencias pueden ocasionarse por :
a) por significativa diferencia del tamaño de las moléculas.
b) por la presencia de átomos de mucha diferencia en la cantidad de electrones o de muy distinta polarizabilidad electrónica.
c) por la circunstancia de presentar una geometría muy diferente.
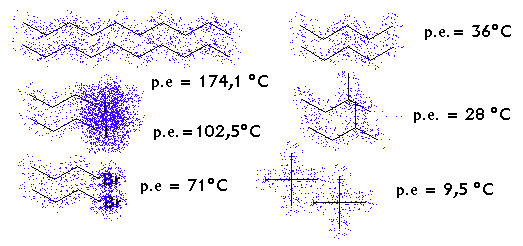
EL CONCEPTO DE MOL Y SUS APLICACIONES
Hemos estudiado a la materia en su dimensiónsubmicroscópica, es decir la realidad de átomos y moléculas. Hemos profundizado el estudio de tal forma que incluso hemos comprendido el comportamiento de las propiedades fisico químicas de sustancias puras, éstas, perfectamente perceptibles y medibles en una dimensiónmacroscópica ( de laboratorio o industria ).
A esta altura de nuestro estudio reconocemos, que en la dimensión macroscópica, no hemos desarrollado las herramientas para trabajar con las sustancias desde el punto de vista cuantitativo, esto es, trabajar con cantidades (masas) definidas de las sustancias que participan en los fenómenos químicos.
No obstante lo expresado, cuando hablamos al comienzo del curso del Peso Relativo de los Atomos o bien del cálculo del Peso Atómico a partir de mezclas de isótopos algo muy importante avanzábamos en el sentido del trabajo cuantitativo. En efecto, cuando determinábamos aquellas magnitudes siempre estaba presente el hecho que comparábamos una misma cantidad de atomos de cada elemento.
La Química cuantitativa comienza con la pregunta fundamental.
¿ Qué cantidad de átomos del elemento hay en el Peso Atómico del elemento expresado en gramos?
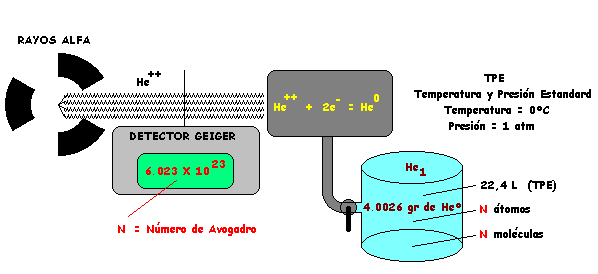
Daremos la respuesta más simple, en base a un experimento también simple esquematizado en el siguiente gráfico.
( Algunos autores prefieren seguir denominando C.N. (Condiciones Normales de P y T ) a las TPE puesto que el término Estandar alude profusamente en la literatura a la temperatura de 25ºC )
Aprovechamos la doble circunstancia que la radiación alfa está constituída por nucleos de Helio, el primero de los gases nobles, cuyo Peso Atómico se ha determinado igual a 4,0026 y que podemos medir la cantidad de núcleos que en la radiación pasan a través del detector de un Contador Geiger.
Colectamos 4,0026 gr. de Helio y leemos en el contador la cantidad de núcleos detectados y luego transformados en átomos. Hemos colectado 6,023. 10 23 átomos de Helio. Esta es la respuesta, válida para todos los elementos, a la pregunta formulada:
En el Peso Atómico de un elemento expresado en gramos existen 6,023 .10 23 átomos del Elemento.
Si pesaramos en la balanza de una confitería 51 de gramos de virutas de vanadio metálico estaríamos pesando aproximádamente 6,023 10 23 átomos de vanadio puesto que el Peso Atómico de ese metal se ha determinado como igual a 50,94.
El valor 6,023 1023 fué determinado por Avogadro mediante cálculos estadísticos acerca de sistemas gaseosos y de ahí que se reconoce como el Número de Avogadro ( N ).
N = 6,023 .10 23
Este valor pasa a ser de importancia central en la química cuantitativa y es la base de la definición del concepto de mol
DEFINICIÓN DE MOL
Un Mol es 6,023 10 23 unidades.
Así el mol pasa a ser una forma adecuada de medir cantidades de partículas de la química, como recién lo dijimos, podemos medir cómodamente un mol de átomos de Vanadio o un mol de átomos de cualquier otro elemento en la balanza de una confitería.
Pero el Número de Avogadro de átomos es una cantidad tan grande de átomos o bién los átomos sontan pequeños y livianos que son magnitudes que desafían nuestra imaginación. Según nos hizo notar recientemente un colega, si tuvieramos una hilera de1 mol de hormigas de 1mm cada una separadas cada una de la precedente por una distancia también de 1mm, la longitud de la hilera cubriría 1,2046 10 18Km. Tal hilera cubriría mil doscientos setenta y ochomillones de veces la trayectoria circular de la Tierra alrededor del Sol.
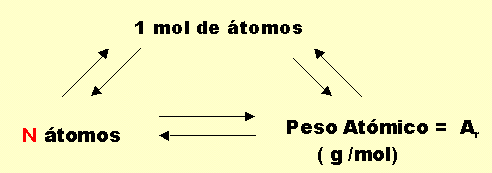
NUEVA DEFINICIÓN DE PESO ATOMICO
El Peso Atómico de un elemento ( A r ) es la masa de un mol de átomos de tal elemento expresada gramos.
Sus unidades de medidas serán por consiguiente gramos / Mol de átomos
Es conveniente comprender la correspondencia entre los elementos del siguiente triángulo de conceptos.
EL MOL DE MOLECULAS
Volvamos a nuestra experiencia de recolección de Helio puesto que podemos sacar mucho más provecho de ella y coloquemos a nuestro sistema en situación comparativa con otros.
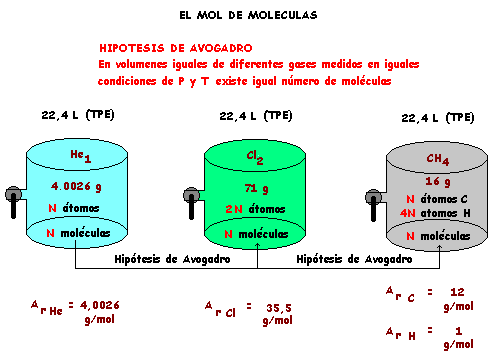
Recordemos que nuestra muestra de Helio gaseoso ocupa un volumen de 22,4 Litros medidos en TPE y hay en ella N átomos, que son también N moléculas, pues el Helio tiene la molécula monoatómica. ( He1 )
Tomemos idéntico volumen de otros gases por ejemplo cloro gasoso ( Cl2 ) y de metano ( CH4 ) medidos también en TPE. De acuerdo a lo establecido por Avogadro en su célebre hipótesis, en los tres sistemas hay igual número de moléculas. Esto quiere decir que en cada uno de los tres casos hay Nmoléculas. También quiere decir que en cada uno de los casos nos encontramos frente a un mol de moléculas de cada gas.
Podemos generalizar:
Un mol de moléculas de cualquier gas medido en TPE. ocupa un volumen de 22,4 Litros.
Recién hemos definido que la masa expresada en gramos de un mol de átomos es el Peso Atómico.
Ahora..... ¿Cuál es la masa expresada en gramos de 1 mol de moléculas? La respuesta a esta pregunta nos lleva a otra definición:
DEFINICIÓN DE PESO MOLECULAR
El Peso Molecular ( M r ) de una sustancia es la masa de un mol de moléculas de tal sustancia expresada en gramos.
Sus unidades de medidas serán por consiguiente gramos / Mol de moléculas
Otra vez es conveniente comprender la correspondencia entre los elementos de este nuevo triángulo de conceptos.
INTRODUCCIÓN A UNA REPRESENTACIÓN GRÁFICA
DE MOLES DE ATOMOS Y MOLES DE MOLÉCULAS
Respecto de los volumenes de gases colectados, tres formas de preguntar lo mismo:
¿Cuál es la masa de un mol de moléculas de cada uno de los gases?
¿ Cuál es el Peso Molecular de cada uno de los gases?
¿Cuánto pesan N moléculas de cada uno de los gases?
Veamos los casos de uno en uno..
En el primer recipiente hay N átomos de Helio, esto es un mol de átomos de Helio que pesa el Ar He = 4,0026 g /mol y puesto que, en este caso la molécula es monoatómica ( He1), son también N moléculas de helio o sea un mol de moléculas. Luego el M r He , el peso de un mol de moléculas, es también igual a 4,0026 g/mol.
Observemos que en este caso, a nivel submicroscópico, una molécula es un átomo y que a nivel macroscópico un mol de moléculas es un mol de átomos. Ambos niveles los representamos graficamente, dibujamos el átomo o molécula de Helio para el nivel submicroscópico y para el nivel macroscópico representamos gráficamente el mol de átomos o mol de moléculas como una ampliación de lo submicroscópico
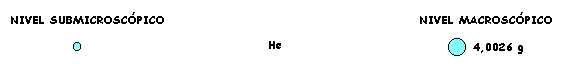
En el caso del segundo recipiente, cada molécula de Cl2 está formada por 2 átomos de Cloro. Luego las Nmoleculas de Cl2 corresponden a 2N átomos de Cloro y la masa de estas será 2 veces la masa de N átomos de cloro, dos veces el Ar Cl =35,5 g. Por lo tanto El MrCl 2 = 71 g/mol
Observamos en las representaciones gráficas de este caso que, a nivel submicroscópico una molécula está formada por dos átomos y que a nivel macroscópico (ampliación) un mol de moléculas está formado pordos moles de átomos.
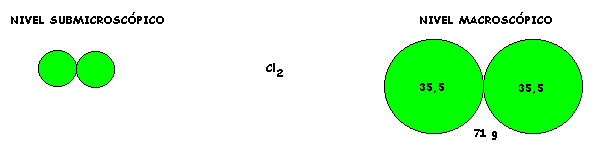
Para el tercer recipiente las N moléculas de metano ( CH4 ) pesaran la suma de N atomos de carbono más lo que pesan 4N atomos de hidrógeno. Esto es la suma de una vez el Ar C = 12 más 4 veces el Ar H = 1. Por lo tanto el Mr CH4 = 1*12 + 4*1 = 16 g/mol.
Aquí observamos en las representaciones gráficas que, a nivel submicroscópico una molécula está formada por un átomo de C y cuatro átomos de H y que a nivel macroscópico (ampliación) un mol de moléculas está formado por un mol de átomos de C ycuatro moles de átomos de H.
CALCULO DEL PESO MOLECULAR
Generalizando, si una Sustancia tiene por FórmulaAaBbCc........
A nivel submicroscópico su molécula está formada por a átomos de A, b átomos de B y c átomos de C etc...
y a nivel macroscópico el mol de moléculas está formada por a moles de átomos de A, b moles de átomos de B y c moles de átomos átomos de C etc... y de allí que el Peso Molecular se calcule con la siguiente fórmula.
Mr AaBbCc........ = a * Ar A + b * Ar B + c * ArC +........
¿Cuánto vale el Peso molecular del Cloroformo CHCl3?
Mr CHCl3 = 1 *12 + 1 * 1 + 3 * 35,5 = 119,5 g/mol
También podemos generalizar importantes conceptos acerca de un doble significado, a nivel submicroscópico y a nivel macroscópico, de la notación química de Símbolos, Fórmulas y Ecuaciones.
Presentaremos este doble significado valiéndonos derepresentaciones gráficas para las entidades submicroscópicas y las representaciones gráficas ampliadas para los conceptos (de moles) usados a nivel macroscópico.
NOTACIÓN QUÍMICA
Nivel Submicrocópico Nivel Macroscópico
SÍMBOLO
1 átomo 1 mol de átomos
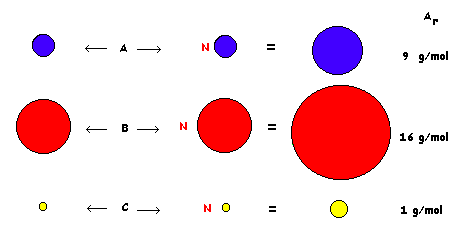
FÓRMULA
1 molécula 1 mol de moléculas
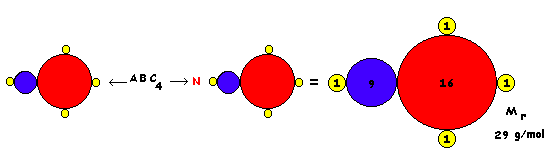
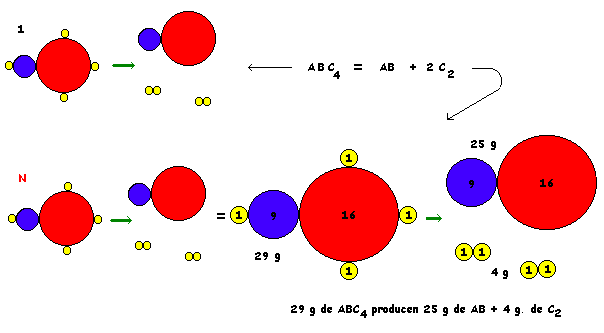
ECUACIÓN
1 reordenamiento
1 mol de reordenamientos
TRABAJO CON FRACCIONES DE MOLES
EJERCICIO DE PRESENTACIÓN DE RELACIONES DE CALCULO
Dados 0,16 g. de metano gaseoso ( CH4 ).
¿Cuántos moles de moléculas son? Ar C = 12 ; Ar H = 1
M r = 1 * 12 + 4 * 1 = 16 (g/mol)
n = N° moles de moléculas Sustancia = masa Sustancia / M r Sustancia =
= 0,16 (g) / 16 (g/mol) = 0,01 moles de moléculas.
¿ Cuántas moléculas de metano son?
N° de moléculas Sustancia = N° de moles de moléculasSustancia* N =
= 0,01 (moles) * 6,023.1023 (moléculas/mol) = 6,023.1021 (moléculas )
¿Cuántos átomos de carbono y cuántos átomos de hidrógeno?
N° de átomos Elemento = N° moléculas Sustancia * Atomicidad Elemento
N° de átomos C = 6,023. 1021 (moléculas ) 1 (átomo/molécula) = 6,023. 1021 átomos C
N° de átomos H = 6,023. 1021 (moléculas ) 4 (átomo/molécula) = 24,092. 1021 átomos H
¿ Cuántos moles de átomos de carbono y cuántos moles de átomos de hidrógeno?
N° de moles de átomos Elemento= N° de moles de moléculasSustancia* Atomicidad Elemento
N° de moles de átomos C = 0,01 ( moles de moléculas)* 1( mol de átomos/mol de moléculas)
= 0,01 (moles de átomos de C)
N° de moles de átomos H = 0,01 ( moles de moléculas)* 4( mol de átomos/mol de moléculas)
= 0,04 (moles de átomos de C)
Otra forma de calcular el número de átomos:
N° de átomos Elemento = N° de moles de átomos Elemento * N
N° de átomos C = 0,01 moles de átomos C * 6,023.1023 (átomos/mol) = 6,023. 1021 átomos C
N° de átomos H = 0,04 moles de átomos H * 6,023.1023 (átomos/mol) = 24,092. 1021 átomos H
¿Cuántos gramos de carbono y cuántos gramos de hidrógeno?
masa Elemento = N° de moles de átomos Elemento * A r Elemento
masa C = 0,01 moles de átomos C * 12 g/mol = 0,12 g C
masa H = 0,04 moles de átomos H * 1 g/mol = 0,04 g H
¿ Cuál es la composición porcentual en peso de cada elemento?
% Elemento = (masa Elemento/ masaSustancia ) 100
% C = (0,12 / 0,16 ) 100 = 75 %
% H = (0,04/ 0,16 ) 100 = 25 %
PROPIEDADES INTENSIVAS Son aquellas propiedades del sistema cuyo valor no depende del tamaño del mismo, es decir son independientes de la masa del sistema.
PROPIEDADES EXTENSIVAS Son aquellas propiedades del sistema cuyo valor sí depende del tamaño del mismo, es decir son dependientes de la masa del sistema.
La composición de un sistema expresada en % en peso es una magnitud INTENSIVA.
Una magnitud intensiva debe poder calcularse con una relación independiente del tamaño del sistema.
% Elemento = (Atomicidad Elemento A r Elemento / M rSustancia )*100
% C = ( 1 * 12 / 16 )100 = 75 %
% H = ( 4 * 1 / 16 )100 = 25 %
¿Cuál es el volumen del sistema en TPE.?
Volumen Gas TPE = N° de moles de moléculas 22,4 (L/mol)
Volumen Gas TPE = 0,01 (moles) * 22,4 (L/mol) = 0,224 (L)
¿ Cuál es la densidad del sistema a TPE.?
Densidad = masa / Volumen
Densidad = masa / Volumen = 0,16 (g) / 0,224 (L) = 0,714 (g/L)
La densidad es una propiedad intensiva, que depende sólo de la Presión y la Temperatura luego:
Densidad Gas TPE = M r / 22,4
Densidad Gas TPE = 16 (g/mol) / 22,4 (L/mol) = 0,714 (g/L)
¿Cuál sería el valor del volumen del sistema y el valor de su densidad si las condiciones de Presión y Temperatura fueran cualesquieras otras, distintas de TPE?
LA ECUACIÓN DE ESTADO DE LOS GASES IDEALES.
Para dar adecuada respuesta a la pregunta planteada es necesario averiguar las relaciones matemáticas que expresan el comportamiento de las distintas variables que determinan el estado de un sistema gaseoso. Un sistema gaseoso se encuentra en un estado definido cuando, además de precisarse la naturaleza del gas, se conocen tres de las siguientes cuatro variables:
n = Número de moles, V = Volumen, P = Presión y t = temperatura.
Para comenzar el estudio de las relaciones es conveniente definir el Volumen Molar
Volumen Molar = V = V / n (L/mol)
Ley de Boyle
Volumen Molar vs. Presión
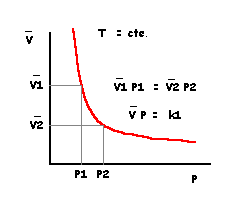
Ley de Charles
Volumen Molar vs. temperatura
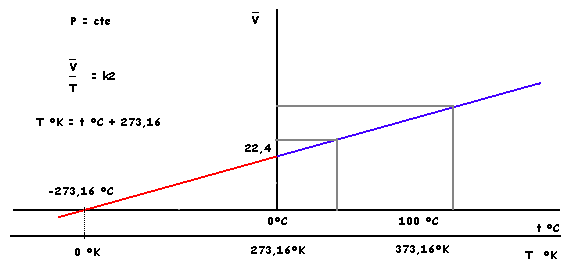
Ambas leyes se pueden agrupar en una sóla expresión:
(V P) /( n T) = k1 k2 = R = 22,4 (L)*1 (atm) /1 (mol)* 273,16 ( °K) = 0,082 (L atm / mol °K)
Esta relación corresponde a la a Ecuación de Estado de los Gases Ideales cuya expresión más común es :
PV = n R T donde R = 0,082 (L atm / mol °K)
Esta relación es aplicable a los gases reales dentro de márgenes no extremos de Presión y temperatura.
Reiterando la pregunta: ¿Cuál sería el valor del volumen del sistema y el valor de su densidad si las condiciones de Presión y Temperatura fueran cualesquieras otras, distintas de TPE?
¿Si por ejemplo la muestra de metano estuviera a 100 °C y 1000 mmHg. (1atm = 760 mmHg)?
V = nRT/P = 0,01(mol) 0,082 (L atm / mol °K) 373,16 °K / (1000 mmHg / 760 mmHg/atm) = 0,232 (L)
densidad P,T = masa / Volumen = 0,16 (g) / 0,232 ( L ) = 0,69 ( g / L )
Pero como ya hemos establecido, la densidad es una propiedad intensiva y debería poder calcularse de datos independientes del tamaño del sistema.
densidad P,T = masa / Volumen = n M r / ( n R T / P) = Mr P / R T
densidad P,T =
=16 ( g/mol)* (1000 (mmHg) / 760 (mmHg/atm)) / 0,082 (L atm / mol °K)* 373,16 °K =
= 0,69 ( g / L )
MÉTODO DE DETERMINACIÓN DEL PESO MOLECULAR
La determinación experimental del valor de Mr es de fundamental importancia cuando no se conoce la fórmula de alguna sustancia. Si la sustancia se puede evaporar podemos aplicar la ecuación anterior pero para calcular el Peso Molecular.
Mr = densidad P,T RT / P
DETERMINACIÓN
DE FÓRMULAS EMPÍRICAS Y MOLECULARES
Mostraremos a continuación la forma sistemática de determinar las fórmulas empíricas y las moleculares haciendo uso de los conceptos de Ar y Mr.
ANALISIS QUÍMICO _ Ar__> FÓRMULA EMPÍRICA_Mr_> FÓRMULA MOLECULAR
Composición % Relación en el número de Atomos Número Exacto de átomos
Los datos de composición de un compuesto entregados por el Análisis Químico a la forma de composición porcentual de los elementos, es por lo general, el punto de partida. Como ya hemos establecido éstas magnitudes son de tipo Intensivas. Sin embargo, para poder calcular el número de moles de átomos, que es esencialmente de tipo extensivo, es preciso trabajar con un sistema detamaño definido y adecuado a los datos y cálculos. Esto es, nos damos una Base de Cálculo (B.C.),por lo general 100 g. de la Sustancia, y así trabajamos con masas determinadas de los diferentes elementos.
Ejemplo: Dada la composición en % que se indica y Ar C = 12 y Ar H = 1
Fórmula Empírica
| % | Base de Cálculo. | masa elemento (g) | N° moles de átomos =MasaElemento/Ar | Relación entre los números de moles de átomos.Se divide por el menor valor N° de moles de átomos (*) |
| 85,71 % C | 100 g. Compuesto | 85,71 | 85,71 / 12 = 7,1425 * | 7,1425 / 7,1425 = 1 |
| 14,28 % H | 14,28 | 14,28 / 1 = 14,28 | 14,28 / 7,1425 = 1,999 = 2 |
En la molécula, el número de átomos de H es el dobleque el número de átomos de C.
Esto equivale decir que la fórmula empírica es CH2.Además " Mr " Empírico = 12*1+1*2= 14 (g/FE)
Fórmula Molecular
La Fórmula Molecular indica la cantidad exacta de átomos de cada elemento en la molécula. Esa cantidad exacta de átomos debe mantener laproporción observada en la fórmula empírica, por lo tanto, la fórmula Molecular debe ser (CH2 )mdonde m es un número entero por determinar.
Si m = 1 Mr CH2 = 14 * 1 (g/mol)
Si m = 2 Mr ( CH2 ) 2 = 14 * 2 (g/mol)
Si m = 3 Mr ( CH2 ) 3 = 14 * 3 (g/mol)
Si m = m Mr ( CH2 ) m = Mr Empírico * m (g/mol)
m = Mr / "Mr" Empírico
Si el problema de ejemplo continúa : la sustancia es un gas a 90 °C y 1 atm y en estas condiciones tiene una densidad de 2,82 (g/L). Es la información requerida para el cálculo de Mr y de allí calcular m.
Recordamos la relación para calcular Pesos Moleculares experimentalmente:
de la Ecuación de estado de los Gases Ideales obteníamos:
densidad P,T = Mr P / R T y de allí :
Mr = densidad P,T RT / P
Mr = 2,82 (g/L) 0,082 ( L atm/mol °K) 363,16 °K / 1 atm = 83,97 (g/mol)
m = Mr / Mr Empírico = 83,97 ( g/mol ) / 14 ( g /F.E ) = 5,99 = 6
Por lo tanto la Fórmula Molecular, también conocida como Real o Verdadera es :
( CH2 )6 = C6 H12
| NOTA IMPORTANTE: Cuando se calcula la relación o proporción en que se encuentran los moles de átomos no siempre resulta ser de números enteros, en ese caso la relación debe ser llevada a números enteros poramplificación o, con decimales muy próximos a enteros, por aproximación. Los siguientes ejemplos son ilustrativos: | ||||
| relaciónA 1 * 2 = 2 B 2,5 * 2 = 5 | relaciónA 1 * 3 = 3 B 1,33 * 3 = 4 | relaciónA 1 * 4 = 2 B 2,25 * 4 = 9 | relación A 1 * 5 = 5 B 1,20 * 5 =6 | relaciónA 1 B 2.9 = 3 |
SOLUCIONES